Bilim Tarihinin Harika Haritası Periyodik Tablo Nasıl Bir Araya Geldi?
Bilimin ve kimyanın temellerini oluşturan periyodik tablo bir dönem hepimizin hayatına girmiştir. Peki bu etkileyici tablonun nasıl oluştuğunu hiç merak ettiniz mi?
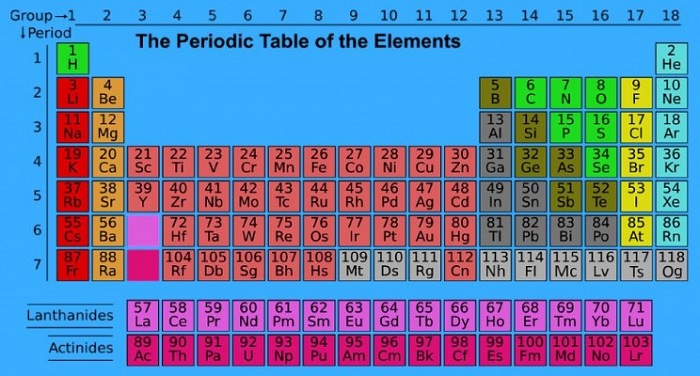
Kimya bilimini belli bir düzene oturtmak isteyen bilim insanları, elementleri belirli bir tablo üzerinde sıralama ihtiyacı duymuşlardı. Günümüzde bilinen binlerce farklı maddeyi oluşturan ve tabiatta var olan element sayısı 92 tane olmasına rağmen bu elementlere yapay yollarla elde edilenleri eklediğimizde sayı 117’ye çıkar. Söz konusu elementlerden altın, bakır, demir gibi bazıları ise binlerce yıldır insanlık tarafından bilinmektedir.
19. yüzyılın başlarına kadar yaklaşık 40 civarında element bilinmesine rağmen bu elementlerin fiziksel ve kimyasal özellikleri arasındaki benzerlikler üzerinde de durulmaya gereksinim duyulmuştur. Ancak elementlerin sayılarının giderek artması bunların özelliklerinin de tek tek incelenmesini zorlaştırmıştı. Bu nedenle bilim insanları elementleri kapsamlı bir şekilde sınıflandırma ihtiyacı duyarak, günümüzün periyodik sisteminin temellerini attılar.
Bu bağlamda çalışmalarda bulunan araştırmacılardan Rus bilim insanı Dmitri Mendeleev, en doğru tabloyu oluşturarak, 63 elementi atom kütlelerine göre belirli sıraya dizmiş ve kendi adıyla anılan periyodik sistemini oluşturmuştu. Daha sonrasında X-ışınları ile ilgili yapılan deneyler sonucunda, kimyasal özelliklerin atomlara bağlı olduğu görülmüş ve elementlerin periyodik sisteme, atom numaralarına doğru dizilmesi gerektiği düşünülmüştü. Ardından geliştirilmesi bırakılmayan sisteme F bloğu da eklenerek, günümüzde kullanılan periyodik sistemin temelleri atıldı.
Günümüzde birçok alanda kullanılan periyodik tablonun özellikleri ise şu şekildedir:
Bir Periyotta Soldan Sağa Doğru Gidildikçe ;
- Atom no, kütle no, proton sayısı, atom kütlesi, nötron sayısı, elektron sayısı, değerlik elektron sayısı artar.
- Atom çapı ve hacmi küçülür.
- İyonlaşma enerjisi artar.
- Elektron ilgisi ve elektronegatifliği artar. (8A hariç)
- Elementlerin metal özelliği azalır, ametal özelliği artar. (8A hariç)
- Elementlerin oksitlerinin ve hidroksitlerinin baz özelliği azalır, asitlik özellik artar. (8A hariç)
- Elementlerin indirgen özelliği azalır, yükseltgen özelliği artar. (8A hariç)
Bir Grupta Yukarıdan Aşağıya Doğru İnildikçe ;
- Proton sayısı, nötron sayısı, elektron sayısı, çekirdek yükü, Atom no, Kütle no artar.
- Atom çapı ve hacmi büyür.
- Değerlik elektron sayısı değişmez.
- İyonlaşma enerjisi, elektron ilgisi ve elektronegatiflik azalır.
- Elementlerin metal özelliği artar, ametal özelliği azalır.
- Elementlerin, oksitlerin ve hidroksitlerin baz özelliği artar, asit özelliği azalır.
- Elementlerin indirgen özelliği artar, yükseltgen özelliği azalır.
Periyodik tabloyu, görebildiğiniz gibi genel olarak Dmitri Mendeleev oluşturmuş olsa da, tablo yüzyıllar boyu geliştirilerek hepimiz için işlevsel bir hal almıştır. Peki siz bu bilim harikası hakkında neler düşünüyorsunuz?
Kaynak : webtekno.com