Isı Tedavisi Kemoterapiyi Daha Etkili Hale Getirebilir
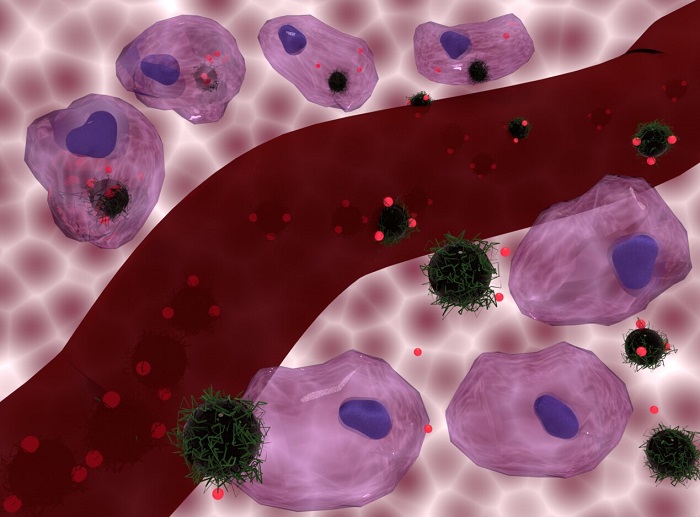
Fotoğraf: Doksorubisin yüklü nanokompozit taşıyıcıların hücreler tarafından özümsenmesi (üstte) ve hücrelerin dışında kalan (altta), merkezde bir kan damarı ile algılanması. Journal of Materials Chemistry B / Nguyen T.K. Thanh / Florian Aubrit / Olivier Sandre / Lilin Wang.
University College London (UCL) araştırmacıları tarafından yürütülen yeni bir araştırmaya göre, kanser hücrelerini kemoterapi ile hedef alırken ısıtmak, onları öldürmenin oldukça etkili bir yolu.
Journal of Materials Chemistry B’de yayınlanan çalışma, bir kemoterapi ilacının kanser hücrelerini ısıtarak aynı zamanda onlara ilacı verebilecek manyetik nanopartiküllere yüklenmesinin, kanser hücrelerini yok etmede ısı eklenmemiş kemoterapi ilacına göre, %34’e kadar daha etkili olduğunu buldu.
Kemoterapi ilacını taşıyan manyetik demir oksit nanopartiküller, değişen bir manyetik alana maruz kaldıklarında ısı yayarlar. Bu da, nanopartiküllerin tümör alanında biriktikten sonra, vücut dışından alternatif bir manyetik alan uygulanarak, ısı ve kemoterapinin aynı anda uygulanmasına izin verebileceği anlamına gelir.
İki tedavinin etkileri ise sinerjikti – yani birlikte kullanıldıklarında ayrı ayrı kullanımlarından çok daha etkili oldular. Çalışma, bir laboratuvardaki hücreler üzerinde gerçekleştirildi ve hastaları içeren klinik denemelerden önce daha fazla araştırma yapılması gerekiyor.
Kıdemli yazar Profesör Nguyen T. K. Thanh (Biyofizik Grubu, UCL Fizik ve Astronomi) şunları söyledi: “Çalışmamız, kemoterapiyi manyetik nanopartiküller yoluyla uygulanan ısıl işlemle birleştirmenin muazzam bir potansiyele sahip olduğunu gösteriyor.”
“Bu tedavi kombinasyonu, hızlı büyüyen gliyoblastomların tedavisi için halihazırda onaylanmış olsa da, sonuçlarımız geniş bir anti-kanser tedavisi olarak daha yaygın kullanılma potansiyelinin bulunduğunu göstermektedir.”
“Ayrıca, bu terapi, sağlıklı dokudan ziyade kanser hücrelerine daha yüksek oranda hedeflenilmesini sağlayarak kemoterapinin yan etkilerini azaltma potansiyeline de sahiptir. Bunun daha ileri klinik öncesi testlerde araştırılmasına ihtiyaç vardır.”
Bu çalışmada araştırmacılar, manyetik nanopartikülleri yaygın olarak kullanılan bir kemoterapi ilacı olan doksorubisin ile birleştirdiler ve bu kompozitin çeşitli senaryolarda insan meme kanseri hücreleri, gliyoblastoma (beyin kanseri) hücreleri ve fare prostat kanseri hücreleri üzerindeki etkilerini karşılaştırdılar.
En başarılı senaryoda, ısı ve doksorubisinin birlikte 48 saat sonra beyin kanseri hücrelerinin %98’ini öldürdüğünü, ısısız doksorubisinin ise hücrelerin %73’ünü öldürdüğünü buldular. Bu arada, 48 saat sonunda, meme kanseri hücrelerinin %89’u ısı ve doksorubisin kullanılarak öldürülürken, sadece doksorubisin ile hücrelerin %77’si öldürüldü.
Kanser hücreleri, sağlıklı hücrelere göre ısıya daha duyarlıdır – sıcaklık 42 santigrat dereceye ulaştığında yavaş bir ölüme (apoptoz) uğrarlar, oysa sağlıklı hücreler 45 santigrat derece sıcaklığa kadar dayanabilir.
Araştırmacılar, kanser hücrelerini 40 santigrat dereceye kadar ısıtmanın kemoterapinin etkinliğini artırdığını, yani tedavinin daha düşük nanopartikül dozlarıyla etkili olabileceğini buldu.
Araştırmacılar, terapilerin kombinasyonunun, nanopartiküller kanser hücreleri tarafından absorbe edildiğinde veya özümsendiğinde daha etkili olduğunu ancak, nanopartiküller kanser hücrelerinin dışında kalırken ısı dağıttığında, kemoterapinin de geliştirilmiş olduğunu buldular (bu, verilmesi daha kolay bir tedavi şekli olurdu). Bununla birlikte, daha düşük sıcaklıklarda bu etkiler, yalnızca demir oksit nanopartikülleri özümsendiğinde veya kanser hücrelerinin yüzeyine sıkıca yerleştirildiğinde meydana geldi.
Nanopartiküller ayrıca kemoterapi ilacının sağlıklı dokuya sızmasını önleyen bir polimer kaplamaya sahiptir. Bu kaplama, ısıya ve pH’a duyarlıdır, sıcaklık yükseldiğinde ve nanopartiküller, hücre ortamının geri kalanından daha düşük bir pH’a sahip olan “lizozomlar” adı verilen hücrelerde küçük cepler içinde özümsendiğinde ilacı salmak üzere tasarlanmıştır. İlacın bu hücre içi dağıtımı, özellikle sıcaklık 42°C’ye ulaştığında üstün nitelikli ve sinerjik hücre ölümü etkisi gösteren fare prostat kanseri hücreleri için etkilidir.
Bordeaux Üniversitesi’nden eş yazar Dr. Olivier Sandre şunları söyledi: “Isı, değişen manyetik alan yoluyla üretilebildiğinden, ilacın salınımı, kanser hücrelerine oldukça lokalize olabilir ve potansiyel olarak yan etkileri azaltabilir.”
Kaynak: phys.org