İlaç Geliştiricileri, Hastalığa Bağlı Proteinler Üzerinde Lizin Amino Asidini Araştırdı
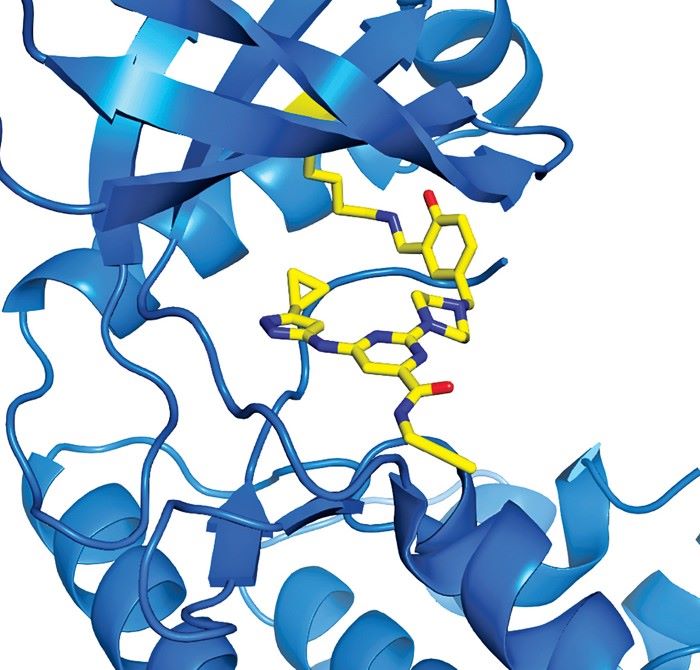
Fotoğraf : Bir aldehit grubu taşıyan küçük bir molekül, bir kinaz proteini üzerindeki bir lizine (mavi şerit üzerindeki sarı segment) kovalent olarak bağlanır.
Kovalent ilaçlar, hastalıkla ilgili proteinler üzerinde sistein hedefleyerek buhar kazandı. Şimdi ilaç geliştiricilerin gözünde ikinci bir amino asit var.
Uygun olmayan proteinler birçok hastalığın arkasındadır. İlaç üreticilerinin bu proteinleri etkisiz hale getirmesinin bir yolu, onlara bağlanan molekülleri dağıtmaktır. Ancak proteinlerin hareketlerini engellemek için sağlam dayanaklar bulmak her zaman kolay değildir.
Proteinlerle kovalent bağlar oluşturan ilaçlar, hedeflerine geri dönüşümsüz olarak tutunur. Bu, daha uzun bir etki süresine sahip oldukları ve bağlandıkları proteinlerden gelip gidebilen kovalent olmayan ilaçlardan daha küçük dozlarda etkili oldukları anlamına gelir. Son yıllarda, kovalent moleküller ilaç geliştiricileri arasında yönelimleri ve doğru tasarlanmaları halinde, kendi hedeflerine seçici bir şekilde bağlanmaları ve bunları iyi bir şekilde kapatmaları nedeniyle giderek daha popüler hale gelmiştir.
İlgili: İlaç hedefleri ararken, kimyagerler lizinlerin haritasını çıkarır
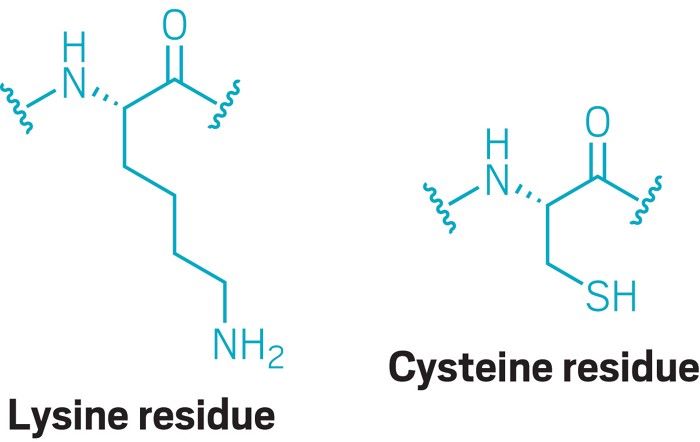
Kovalent ilaçlar genellikle hastalığa neden olan bir proteinin yüzeyinden veya kenarlarından çıkan reaktif amino asit yan zincirlerine odaklanır. Geçtiğimiz birkaç on yıl boyunca, kovalent ilaçlar geliştirme çabaları sisteini hedef aldı. Ama şimdi başka bir amino asit (lizin), ilaç verilebilir hedeflerin alanını büyük ölçüde genişletmeyi vaat ediyor.
Sisteine Bir Alternatif
Kovalent bağlanma yeri olarak sistein iki ucu keskin bir kılıçtır. Bir yandan, bir dereceye kadar seçicilik sunar: insan vücudundaki sistein içeren proteinlerin oranı küçüktür, bu nedenle ilaç moleküllerinin yanlış yere bağlanma olasılığı daha azdır. Öte yandan, birçok protein sisteinden yoksundur ve bu da onları potansiyel kovalent ilaç hedefleri olarak tartışma dışı bırakır.
Lizin, kovalent ilaçlarla hedeflenmek üzere daha birçok insan proteinini kullanıma sunmayı vaat ediyor. Bu amino asit kalıntısı vücuttaki sisteinden yaklaşık üç kat daha fazladır: her proteinde ortalama 32 lizin bulunur.
Terremoto Biosciences’ın kurucu ortağı ve yönetim kurulu başkanı Peter Thompson, “Kovalent alfabeyi lizine genişletebilmenin muazzam bir faydası var” dedi.
Sistein hedefleyen kovalent ilaçlar üzerinde yapılan araştırmalar, epidermal büyüme faktörü reseptörü gibi kanserle ilgili bazı proteinlerin, sistein kalıntılarını başka bir amino asitle değiştirmek için mutasyona uğrayabildiğini ve ilaç hedefi olan proteini saldırıya karşı dayanıklı hale getirdiğini bulmuştur. Lizin üzerinde arama yapmak, ilaç direncine yol açan mutasyonları toplayan proteinlerin daha düşük bir olasılığını vaat ediyor. Bunun nedeni, kinazlar gibi belirli büyük protein sınıfları için lizinin, proteinin işlevi için kritik öneme sahip olması ve başka bir amino asit ile ikame edilememesidir. Bir ilaç hedefi olarak lizin sadece çok yönlü değildir, aynı zamanda güvenilirdir. Lysine, ilaç endüstrisinden şimdiden ilgi gördü. Kovalent ilaçlar geliştiren birkaç şirket, köklü sistein üzerine odaklandıktan sonra bu amino asidi arıyor. Kısa süre önce lizin bazlı kovalent ilaçlar geliştirmek için ortaya çıkan San Francisco merkezli bir şirket olan Terremoto Biosciences’ın CEO’su ve kurucu ortağı Peter Thompson, “Kovalent alfabeyi lizine genişletmenin muazzam bir faydası var” diyor. Hedeflediği hastalıklarla ilgili ayrıntıları açıklamayan şirket, gelecekte rekabet bekliyor.
Thompson, “Muhtemelen bunun peşinden gidecek birçok şirket olacak” diyor. Uzmanlar, lizinin kovalent bir ilaç hedefi olarak sisteinin on yıldan fazla gerisinde olduğunu düşünüyor. Henüz lizin hedefli ilaçlar mevcut değilken, sistein ilaç geliştiricileri, antikanser ilaçları ibrutinib ve osimertinib gibi oyunun kurallarını değiştiren birkaç ilaçla övünüyor. Ancak Thompson, lizinin kovalentliğinin alanının “biz konuşurken geliştirildiğini” söylüyor. “Çok hızlı hareket ediyoruz – düşündüğümden daha hızlı.”
Lizinin Potansiyeli
Tüm amino asitler arasında sistein, kovalent bir hedef için ilaç üreticilerinin en iyi seçimidir çünkü en nükleofilik ve dolayısıyla reaktiftir. Bu, bir bağ oluşturmak için elektronlarını bir elektrofil ile paylaşmaya amino asitler arasında en istekli olduğu anlamına gelir. Lizin biraz daha az nükleofiliktir, bu nedenle mantıklı bir sonraki kovalent hedeftir.
Yaygınlıklarına rağmen, tüm lizinler, ilaç yerleştirme bölgeleri olarak bir seçenek değildir. 7.4’lük fizyolojik pH’da olduğu gibi asidik veya hatta hafif bazik bir ortama maruz kaldığında, lizin protonlanabilir ve artık bir kovalent bağ yapmaz. Bu nedenle, ilaç keşif çabaları, tipik olarak, bir proteinin iç kıvrımlarında yer alan ve protonasyondan korundukları lizinlerin peşinden gider.
Araştırmacılar, lizinin potansiyelinin kapsamını araştırmak için son zamanlarda ilaca uygun alanlar aramak için insan proteinlerindeki lizin manzarasının haritasını çıkardılar. Çabaları, bu nispeten keşfedilmemiş alanda birçok fırsat gösterdi. Cornell Üniversitesinden kimyager Mikail Abbasov ve meslektaşları, insan bağışıklık hücrelerindeki ve kanser hücrelerindeki proteinleri, proteindeki korunan yerleri göz önüne alındığında hedeflenebilecek lizinler için taradılar. 14.000’den fazla lizinin haritasını çıkardılar; en az 3.000 potansiyel olarak bir kovalent molekül ile ilaçlanabilirdi.
Grup ayrıca çeşitli reaktif grupların farklı bölgelerdeki lizinlere bağlanmadaki etkinliğini değerlendirmek için deneyler yaptı. Bağlanma davranışlarını anlamak, kovalent ilaç tasarımı için bir başlangıç noktası sağlayabilir. Abbasov, “Bu, yalnızca çok çeşitli küçük moleküllerin reaktivitesini değerlendirmekle kalmayıp, aynı zamanda küçük moleküllerin bağlanabileceği lizinler için kanser ve bağışıklık sistemlerinde taranan ilk çalışmaydı” diyor. Lizini arayan kovalent ilaç adayları için manzara çok geniş. “Keşfedilecek çok şey var” diyor.
İlgili: Kovalent ilaçlar, uç alanlardan modaya uygun çabalara gidiyor.
Rockefeller Üniversitesinde immünoloji ve proteomik üzerine çalışan bir kimyasal biyolog olan Katya Vinogradova, “Lizin hedefleme alanında, özellikle son 5 yılda çok fazla çalışma oldu” diyor. “[Lizin kovalent] platformu çok güçlü.”
Bağlamak ya da Bağlamamak
Lizinin sisteinle karşılaştırıldığında daha düşük nükleofilik olması, araştırmacıların ilaç adayları olarak daha reaktif elektrofiller kullanmasını gerektirir. Ancak bu reaktivite, elektrofilleri daha az kararlı hale getirerek, kan dolaşımındaki su, enzimler veya diğer bileşiklerle potansiyel olarak reaksiyona girmelerine neden olabilir. İlaç üreticilerinin elektrofil tasarımında reaktivite ile stabiliteyi dengelemeleri gerekir.
Riverside’daki California Üniversitesinden Maurizio Pellecchia liderliğindeki bilim insanları, bu dengeye her iki yönden de yaklaştılar: bir durumda, oldukça reaktif bir sülfonil florür ile başladılar ve doğru elektron veren gruplara bağlanarak durdurdular. Başka bir durumda, araştırmacılar isteksiz florosülfatları reaksiyona sokmak için bir geçici çözüm tasarladılar. Florosülfat grubunu ilgilenilen lizinin karşısında, ikisinin bir kovalent bağ oluşturmasına yetecek kadar uzun süre tutmak için moleküler bir iskele yaptılar.
Pellecchia, bu özel olarak hazırlanmış florosülfat moleküllerini ticarileştirme yönünde birleştiriyor. KovaLys adı verilen en iyi adayını kansere karşı fare modellerinde test etmek için tohum kaynağı arayışında olan Armida Labs’in başkanı ve kurucusudur.
Kovalent bir ilaç molekülünün anahtar bileşenlerinden biri, ironik bir şekilde, onun kovalent olmayan kısmıdır: elektrofile bağlı olan ligand. Elektrofil amino aside kovalent bağ oluştururken, ligand doğru amino asit hedefini çevreleyen protein çerçevesi ile kovalent olmayan etkileşimlere girer ve böylece ilacı doğru noktaya yönlendirir. Ligand, doğru amino asitle kovalent bir bağın oluşabilmesi için elektrofili yerinde kilitleyerek ilgi alanına yönelik çekiciliği güçlendirir.
Sistein seçici ilaçlar zaten bu numarayı kullanıyor, ancak hedef bol lizin olduğunda daha da kritik.
Örneğin, Kyoto Üniversitesindeki bilim insanları, yüksek oranda reaktif sülfonamid gruplarını, tipik olarak kanser hücrelerinde bulunan bir protein olan Hsp90 üzerindeki bir lizin üzerine yönlendirmek için bir ligand kullandılar (Nat. Commun. 2018, DOI: 10.1038/s41467-018-04343-0). Molekülleri, proteinin ifadesini baskılayabildi ve kanser hücresi büyümesini baskılayabildi.
Araştırmayı yöneten kimyasal biyolog Itaru Hamachi, hacimli ligand olmadan, sülfonamidin protein ortamındaki diğer lizinlere ve hatta su moleküllerine sapacağını söylüyor. “Ligand bize bağlayıcılık ve seçicilik [verdi].”
Kovalent Bağ Yapımı ve Kırılması
Seçicilik elde etmek için ortaya çıkan bir başka strateji ise mantığa aykırıdır: bazı araştırmacılar tam kovalent ilaçlardan proteinlere kovalent ancak geri dönüşümlü bağlanan molekülleri keşfetmek için hareket ediyor. Bu durumda, ilk önce geri dönüşü olmayan bağa sahip kovalent ilaçlar satılıyorken, şimdi bu bağlar kasıtlı olarak kırılabilir olacak şekilde tasarlandı.
Abbasov, “Bunu, iki dünyanın en iyisine sahip bir bileşiğe sahip olarak görüyorum – kovalent ve kovalent olmayan” diyor.
Bağın mühendislik tarafından tersine çevrilebilirliği, ilaç adayının kendi kendini düzeltmesi için yer açarak seçiciliğine katkıda bulunur. Elektrofiller hala güçlü kovalent bağlar oluşturacak kadar reaktif olsa da hedef protein üzerinde en yakın varlığa sahip olduğu lizini bulana kadar hedeflerden ayrılacaklardır.
Tersine çevrilemez elektrofillerin seçiciliği yalnızca bir hız sabitine bağlıdır – California Üniversitesi, San Francisco’da kimyager olan Jack Taunton’a göre, molekülün doğru lizin bölgesine eklediği oran olan açık hız adı verilen bir faktördür. “Tersinir elektrofillerle, aynı zamanda bir kapalı oranınız da var ve bu yüzden size ekstra bir seçicilik boyutu sağlıyor.”
Fotoğraf-1 : İlaç adayı CovaLys, kanserle bağlantılı proteini X’e bağlı apoptoz proteini inhibitöründeki (XIAP) bir lizine kovalent bağlıyor.
Taunton’un araştırmacılardan oluşan ekibi, bu kovalent bağ oluşum oranını göz önünde bulundurarak, aldehid tabanlı kovalent inhibitörlerinin sonunda istenilen proteinlere düştüğünü ve yüksek oranlara rağmen yanlış hedeflere konmadığını gösterdi. Ekip, bu moleküllerin bir koleksiyonunun insan hücre hatları ve farelerde seçici olarak 200’den fazla farklı protein hedefi arayabileceğini gösterdi.
Taunton’un aldehitler üzerine bahse girmek için başka bir nedeni daha var: Bu fonksiyonel gruplara dayanan ve insan vücudunda güvenli olabileceklerini öne süren ilaçlar için bir emsal var. 2019’da ABD Gıda ve İlaç Dairesi, orak hücre hastalığını tedavi etmek için Global Blood Therapeutics’in voxelotorunu onayladı. Bileşik, hemoglobin üzerindeki bir N-terminal amine bağlanmak için bir aldehide dayanır.
Novartis, ticari nedenlerle onu terk etmeye karar vermiş olsa da, şirket, karaciğer kanseri için potansiyel bir tedavi olarak Faz 2 klinik denemeleri boyunca sistein arayan bir aldehit olan tersinir kovalent inhibitör roblitinib’i aldı. Bu moleküllerin hiçbiri lizini hedeflemez, ancak Taunton, aldehit saplı lizin bazlı kovalent bir ilacın güvenli olma ihtimalinin yüksek olduğunu düşünüyor.
Taunton, hassas bir şekilde dengelenmiş, tersine çevrilebilir ajanların mühendisliğinin sonunda daha yüksek bir hedefe ulaşmasına izin vereceğini umuyor: proteinlerin koruyucu iç ceplerinin hemen dışındaki yüzey lizinlerine bağlanan moleküller. Bu hedefler, lizinin nükleofilitisesini zayıflatan su molekülleri ile çevrilidir, bu nedenle elektrofilin reaktivitesi ile tersinir etkileşimlerin stabilitesi arasındaki optimal dengeyi elde etmek zordur.
Taunton, “Kimyaya gerçekten çok dikkat etmeyi gerektirecek” diyor.
Lizin için Yapılacak Çok Şey Mevcut
Etkili kovalent ilaçlar tasarlamak, tüm parçaları bir araya getirmeyi gerektirir. Abbasov, “Her şey önemli – yapı iskelesi, [elektrofil] reaktivitesi ve lizin kalıntısını çevreleyen yerel ortam” diyor. Diğerlerinin üzerinde duran tek bir elektrofil adayı yok; ne kadar çok araştırmacı tasarlayabilirse, bir ilacı bir aday protein üzerindeki spesifik bir lizine göre uyarlamak için o kadar fazla seçenek mevcut olacaktır.
Bolluğuna rağmen, lizin, kovalent seçim hedefi olarak sisteinin yerini almaz. Bunun yerine araştırmacılar, sistein ve lizinin, genel olarak ilaçlanabilir alanı genişletmek için birbirini tamamlayacağını umuyorlar. Araştırmacılar şimdiden tirozin ve serin gibi diğer amino asitleri kovalent olarak yakalamanın yollarını araştırıyorlar. Her biri kendi zorluklarını beraberinde getirir ancak ilaç geliştiricilerin hastalıklarla mücadele repertuarını genişletme potansiyeline sahiptir.
Çok çeşitli seçenekler, ilaç geliştirmenin ötesinde bir kazanç olacaktır: araştırmacılar, bir proteinin sırlarını keşfedebilen kovalent moleküler problarla amino asitleri etiketlemek için aynı kimyayı kullanabilirler. Bağlanacak daha fazla bölgeye sahip olmak, bilim insanlarının yapısını ve işlevini daha iyi anlamak için bir proteini üretmesine ve değiştirmesine olanak tanır.
Abbasov, “Bu alanda yapılacak çok şey var” diyor. “Bu, gelecek için tasavvur edebileceğimiz şeyin sadece başlangıcı.”
Kaynak : acs.org