Yeni Cihaz, Devamlı Elektroliz Yardımıyla Kimyasal Formda Enerji Depoluyor
Kyushu Üniversitesi bir araştırma ekibi direkt olarak alkolik bileşiğe enerji yükleyebilen polimer elektrolit alkol elektro sentez hücresi kullanarak, bir karboksili asitten alkolik bileşiğe devamlı elektrokimyasal sentez gözlemlediler. Masaaki Sadakiyo / karbon-nötr enerji araştırması uluslararası enstitüsü, Kyushu Üniversitesi.
Yenilenebilir enerjiyle ilgilenmek filiz vermeye devam ediyor. Çoğu yenilenebilir enerji güneş parlamayı kestiğinde ya da rüzgâr esmeyi bıraktığında enerji titrer ve sinir bozucu bir şekilde kesintili olabilir. Kararsız beslemenin bir kısmı maksimum enerji depolama sırasında kolay taşınabilir elektriğe dönüşür. Yine de enerji depolamak zorluklarını beraberinde getirmiyor değil.
Son zamanlar da Güney Japon Kyushu Üniversitesine bağlı karbon-nötr enerji araştırması uluslararası enstitüsünden (I2CNER) bir grup sürekli elektrolizden yararlanarak kimyasala formda enerji depolayan bir cihaz geliştirdiler.
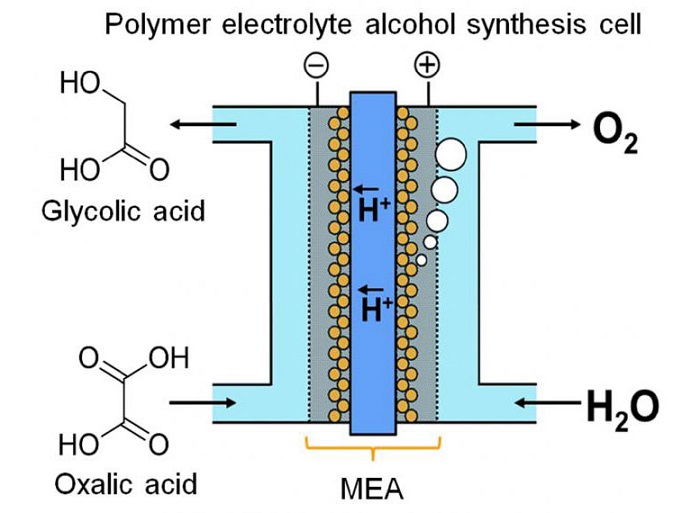
Araştırmacılar glikolik asitin (GC) hidrojenden çok daha iyi bir enerji kapasitesi olduğunu, en meşhur enerji depolayan kimyasallardan biri olduğunu söylediler. GC oksalik asit (OX) dört elektron redüklenmesiyle elde edilebilir, yaygın olarak karboksilik asitten elde edilir. Yayımlanan bilimsel raporlarında belirttikleri üzere cihaz yeni bir zar elektrot düzeneği tabanlı elektrolitik hücrelerden tasarlanmış. İridyum oksit tabanlı anot ve titanyum kaplı titanyum dioksit (TiO2) katottun arasına sıkıştırılmış ve polimer membran ile birbirine bağlanmış.
Proje lideri Masaaki Sadakiyo açıkladı; “akım tipi sistemler sıvı tabanlı reaksiyonlarla enerji depolamak için çok önemli. Bu amaç için uygun olmayan çoğu elektroliz alkol kullanarak kesikli bir işlem sunuyor. Bizim cihazımız elektrotlarla direkt bağlantıda olan sıvı polimer elektrolit kullanarak reaksiyonu kirlilik ilavesi olmadan sürekli bir akımla yürütebilir. OX çözeltisi akışkan bir elektron havuzu olarak düşünülebilir.
Bir başka anahtar değerlendirme de katot tasarımı. Katodik reaksiyon anataz TİO2 tarafından kataliz edilmiştir. Kataliz ve katot arasındaki sıvı bağlantıyı garantiye almak için takım TiO2 yi direkt olarak Ti üzerinde mesh ya da felt formunda ürettiler. Elektron mikroskopunda TiO2 hav şeklinde, taze kar kaplı gibi Ti çubuğun yüzeyine yapışmış halde görüldü. Aslında onun işi OX ten GC ye elektroredüklemeyi katalizlemek. Aynı anda anotta su oksijene oksitlenir.
Ekip yüksek sıcaklıklarda reaksiyonun hızlandığın keşfetti. Ancak sıcaklığı yüksek bir seviyeye çıkarmak suyun hidrojene dönüşmesinde işleminde istenmeyen bir olay. Bu iki etken arasındaki ideal sıcaklık 60 0C’dir. Bu sıcaklıkta reaksiyonun ulaşabildiği yüzey alanı miktarı arttıkça, reaktantların debisi azaldıkça cihaz daha iyi optimize edilir.
İlginç biçimde, TiO2 katalizinin hav yapısı bile büyük bir fark yaratır. İnceltici ve çok yoğun paketlenmiş Ti çubukları büyütülerek TiO2 “felt” olarak hazırlandığında, reaksiyon “mesh” halinden -muhtemelen daha büyük yüzey alanı nedeniyle -daha çabuk gerçekleşti. Aynı zamanda felt yapısı Ti yüzeyini mesh yapısından daha rahat örttüğü, yalın Ti oluşumunu engellediği için hidrojen oluşumunu azaltır.
“Doğru koşullarda, bizim hücrelerimiz neredeyse 100% OX üretimi sağlıyor. Biz GC solüsyonunun maksimum volümetrik enerji kapasitesini hidrojen gazına oranla 50 kat daha fazla hesapladık. Açık olmak gerekirse, bu enerji verimi -kapasitenin tersine- diğer teknolojilerin bir adım gerisinde. Ancak bu fazla akımın toplanmasını sağlayan yeni bir metot için vaat eden bir ilk adım” dedi yardımcı yazar Miho Yamauchi.
Kaynak : scitechdaily.com