İlaç Keşfi için Madencilik Gen İfadesi Verileri
Start-up’lar, eski uyuşturucular için yeni kullanımlar keşfetmek için kısa bir yol olarak uyuşturucu verilerinin engin depolarından yararlanıyor.
Uzun yıllar boyunca ilaç geliştiricileri “tek ilaç, tek hedef” paradigmasını takip etmişlerdir: Belirli bir hastalığı tedavi etmek için tek bir protein veya başka bir biyolojik hedef üzerinde hareket eden bir molekülü tanımlayın ve sentezleyin. Bu yaklaşım maliyetlidir. Amerika İlaç Araştırmaları & Üreticileri’nden alınan bir rapora göre, ortalama olarak, laboratuar tezgahından eczane rafına yeni bir ilacı getirmek için en az on yıl ve 2.6 milyar dolar gerekir. Ve klinik çalışmalara giren ilaçların % 12’sinden daha azı ABD Gıda ve İlaç İdaresi onayını kazanır.
Bununla birlikte, hastalığın biyolojisi oldukça basittir ve genellikle tek bir hatalı proteinden daha fazlasını içerir.
Araştırmacılar bu fikri kabul ettikçe, uyuşturucu geliştirme stratejilerini değiştirmeye başladılar: Bazı geliştiriciler artık gen ekspresyon paternlerini – genetik talimatların nasıl ve ne zaman çözüldüğünü – hücrelerde ve dokularda ölçerek ve bu paternlerdeki değişiklikleri inceleyerek hastalıkları daha geniş bir şekilde karakterize ediyorlar. hastalıklı hücreler ve dokular. Sağlıklı dokuda bulunanlara benzer şekilde, ifade desenlerini tersine çevirenler için geniş bir kütüphane taraması yaparak ilaç geliştirme başarı oranlarını iyileştirmeyi umuyorlar. Bu tür gen ifadesi verilerinin kamu veri tabanlarında mevcut olduğunu kabul ederek, büyüyen bir dizi hesaplamalı ilaç keşif start-up’ları ve akademik araştırma laboratuvarları, orijinal hedeflerinden çok farklı hastalıklara karşı etkinliğe sahip olabilecek bileşikler için bunları elemeye başladı. zeminden bileşikler inşa etmek zorunda kalmaz.
Büyük ilaç şirketleri bile bu tür “büyük veri” analizlerini benimsemeye başladı. Bu yaklaşımın, eski uyuşturucular için şaşırtıcı yeni kullanımları ortaya çıkaracağını ve aynı zamanda düz görmede saklanan şeyleri görmek için hesaplama yöntemlerini kullanarak ilaç geliştirme maliyetini düşüreceğini umuyorlar.
Eski İlaçlar Yeni Yaşam
Geçtiğimiz on yıl içinde, “insanlar tüm bu verilerin mevcut olduğunu fark etmeye başlamışlardı ve bilgisayarlar bu tür işleri yapmak için daha da güçlüydü” diyor California Üniversitesi, Bakar Hesaplamalı Sağlık Bilimleri Enstitüsü Direktörü Atul Butte. , San Francisco. Butte, Stanford Üniversitesi Tıp Fakültesi’nde iken 2013’te bir gösteri ortaya çıktı. O ve meslektaşları, Ulusal Biyoteknoloji Bilgisi Merkezi Gen Ekspresyonu Omnibus gibi kamuya açık verilerden yüz binlerce gen ifade profilini aramak için geliştirdikleri bir veri madenciliği teknolojisini kullandılar. Bu profiller geniş bir hücre ve doku yelpazesine yayılmıştır: sağlıklı ve hastalıklı, aynı zamanda tedavi edilmiş ve ilaçlarla tedavi edilmemiştir.
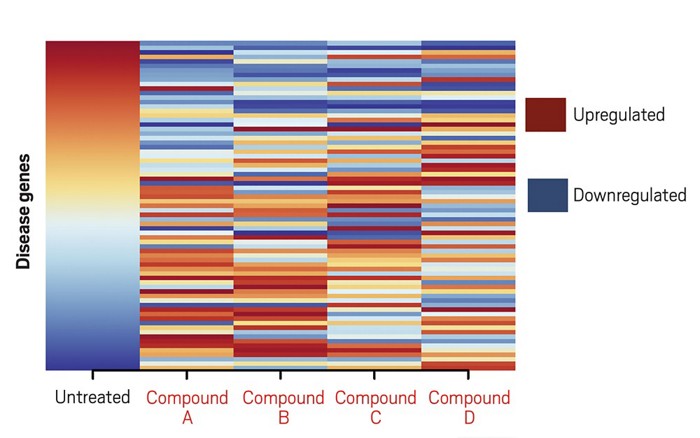
Araştırmacılar, çeşitli ilaç bileşikleriyle tedavi edilmiş olan küçük hücreli akciğer kanseri (SCLC) hücrelerinden ve doku modellerinden elde edilen verileri incelemek için bu yöntemi kullandılar ve sağlıklı akciğer hücrelerinin modellerini daha yakın bir şekilde eşleştiren gen ekspresyon modelleri ile örnek aradılar. Daha sonra bu geri dönüşlere yol açan bileşiklerin bir listesini derlediler. Buradaki fikir, örneğin, belirli genlerin SCLC hücrelerinde sürekli olarak yüksek bir ifade göstermesi durumunda, ifadelerini azaltan bir ilacın, başka bir hastalık için onaylanmasına rağmen, durumu tedavi edebileceği düşünülmektedir. Gelecek vaat eden bileşiklerin listesinin başında trisiklik antidepresanlar vardı.
Araştırmacılar, bir aday, imipramin denen bir trisiklik antidepresan üzerinde durdu. Butte ve ekibi, imipraminin laboratuarda ve insanlarda programlanmış hücre intiharı veya apoptosis geçirecek şekilde farelerde büyüyen insan SCLC hücrelerini teşvik ettiğini gördüler. İlaç ayrıca SCLC tümörlerini taşıyan farelerde metastazları yavaşlattı veya önledi. Nöroblastoma olarak bilinen bir pediyatrik tümör de dahil olmak üzere diğer nöroendokrin tümörlerin büyümesini bloke etti. Ekibin sonuçlarından cesaret alan Butte’in Stanford’lu meslektaşı Joel Neal, araştırmacıları, SCLC’li ve diğer yüksek derecede agresif nöroendokrin tümörlü hastalarda, imipramine benzer bir molekül olan desipraminin klinik çalışmalarını başlatmaya götürdü. Ancak Faz II çalışmalarından sonra baş dönmesi, uyuşukluk ve yorgunluk da dahil olmak üzere kabul edilemez yan etkiler ortaya çıktığından, ekip ilacı geliştirmeyi bırakmak zorunda kaldı.
Fotoğraf : Aday ilaç bileşikleri (A, B, C, D), kanser hücrelerinde gen ekspresyon paternini değiştirir. Tedavi edilmeyen, hastalıklı hücrelere (ilk sütunda gösterilen) göre ekspresyon şablonunu (ve dolayısıyla renk paternini) yaklaşık olarak tersine çevirenler, aday tedavilerdir. Örneğin, A ve B bileşikleri buradaki deseni tersine çevirir.
Yine de, yaklaşım araştırmacıları, sıfırdan bir bileşik geliştirmenin zaman ve gayretinden kurtarıyor, diyor, Butte’nin ekibinin veri madenciliği teknolojisini lisanslayan NuMedii’nin kurucusu ve CEO’su Gini Deshpande, bunu daha sonra geliştirdi ve Yapay Zeka Bulguları İçin Yapay Zeka (AIDD) olarak yeniden adlandırdı . “Bu, yeni bağlantılar bulmamıza ve uyuşturucu keşfinin temelini oluşturabilecek yeni biyolojiyi tanımlamamıza olanak tanıyor” diyor. Şirket test etmek için yeni bileşikler aramaya devam ediyor.
Ve desipramin denemesi mutlaka çıkmaz bir sonuç değil diyerek, ekliyor: “imipramini daha az yan etkiye sahip olacak şekilde değiştirmeyi hayal edebiliyorsunuz.” FDA halihazırda kamu veri tabanlarındaki pek çok ilacı insan kullanımı için onayladığı için, araştırmacılar bunları klinik çalışmalara getirebilir. Yeni bir bileşenden çok daha hızlı. Deshpande, hedefe ulaşan terapötik bir hedef ve aday bileşiklerin tanımlanmasının, artı ilgili klinik öncesi modellerde ve insanlarda güvenli testlerin yapılmasını sağlamak için gereken klinik öncesi çalışmaları yürütmenin tüm sürecinin ortalama altı yıl sürdüğünü söylüyor. Stanford araştırmacıları, veri madenciliği teknolojisinin kurşun bileşikleri belirledikten iki yıldan kısa bir süre sonra ilk klinik denemelerini başlattılar.
NuMedii de SCLC’nin ötesine bakıyor. Daha sonra Aptalis olarak bilinen bir ilaç şirketi ile işbirliği içinde, NuMedii, enflamatuar bağırsak hastalığı, ülseratif kolit ve Crohn hastalığı dahil olmak üzere gastrointestinal bozuklukları tedavi etmek için sık sık yüksek kan basıncını tedavi etmek için kullanılan β − blokerlerin kullanımı için 2014 yılında bir patent başvurdu.
NuMedii eski ilaçlara yeni hayat vermek için veri madenciliğini kullanmaktan çok uzaktır. Ayrıca Bakar Enstitüsü’nde bulunan ve Butte ile algoritmanın geliştirilmesine yardımcı olan Marina Sirota, algoritmayı kullanmaya devam etti ve şu anda karaciğer kanseri, bazal hücreli karsinom ve diğer durumlar için ilaç yollarını arıyor. Ekibi, kan damarlarını daraltan bir ilaç sınıfının, dermatomiyozit denilen bir otoimmün hastalığı tedavi edebileceğini doğru bir şekilde tahmin etmek için az sayıda hasta ile yapılan bir denemede yöntemi uygulamıştır (J. Invest. Dermatol. 2016, DOI: 10.1016 / j). .jid.2016.03.001).
Ülkenin diğer tarafında, Connecticut tabanlı BioXcel, mevcut ilaçları yeniden ele geçirmek için benzer veri madenciliği yaklaşımlarını kullanmaktadır, bunlardan bir kısmı Faz I ve Faz II çalışmalarıdır. Bunlar kan kanserleri, demans ve bipolar bozukluğu tedavi edebilen bileşikleri içerir. Birleşik Krallık’ta, Healx nadir hastalığa karşı gözle büyük veri madenciliği yapıyor. Şirket kısa bir süre önce, bozulmuş nörolojik gelişime ve kontrol edilemeyen nöbetlere yol açan bir genetik bozukluk olan CDKL5 sendromu için olası bir tedavi olarak tianeptin adı verilen bir antidepresan tanımlamıştır (Hum. Mol. Genet. 2018, DOI: 10.1093 / hmg / ddy108). Fransa’daki Pharnext, hastalıkları tedavi edebilecek mevcut ilaçların kombinasyonlarını oluşturmak için büyük veri analizleri kullanıyor. Aday komodilerinden biri, bu yılın sonunda beklenen sonuçlarla birlikte, Charcot-Marie-Tooth hastalığı olarak adlandırılan bir başka nadir nörolojik bozukluğun tedavisi için Faz III klinik çalışmalarında bulunmaktadır.
Maden ya da Büst
Deshpande, ilaç endüstrisinin kestirme başarı oranlarının çok az seçenek olduğunu ancak veri madenciliğini geleneksel tek ilacı, tek hedefli bir yaklaşıma alternatif olarak değerlendirdiğine inanıyor. “Başarılı bir ilacı keşfetmek için 1 milyar dolara 4 milyar dolar harcıyorsunuz”.Hastalık sayısını düşündüğünüzde, “matematik eklemiyor” diyor. Büyük veri yaklaşımları ilaç geliştiricilerinin daha az ot tüketmesine izin verebilir. yıldız adayları erken. “Bazı başarısızlıklarla sonuçlansak bile, hızlı bir şekilde başarısızlığa geçmek bir endüstri olarak zorunludur” diyor. “Başarısız olursanız, daha düşük maliyetler için hızlı bir şekilde başarısız olun.”
Emin olmak gerekirse, büyük veri yaklaşımları, özellikle de uyuşturucuların yeniden kullanılması söz konusu olduğunda ticari engellerle karşı karşıyadır. Klinik çalışmalarda ilerlemek için, Michigan Eyalet Üniversitesi Bin Chen ve meslektaşları geçtiğimiz yıl, veri madenciliği sisteminin öngördüğü patentli bir ilacı ruhsat vermeye çalıştıklarını ve bunun da başlangıçta amaçlanandan başka bir hastalığı tedavi edebileceklerini söylediler. (Chen, ilacı açıklamıyordu.) “Büyük bir şirketi, bileşiklerini bir akademik laboratuara veya bir işe alma konusunda ikna etmek kolay değil,” diyor Chen. Şimdilik, Chen’in ekibi, bileşiği yeniden tasarlayarak, sorunu çözmek için yapay zeka yöntemlerini deniyor ve bu da patent ihlalinden kaçınmak için orijinalinden yeterince farklı yapıyor.
Hermann Mucke, H.M. Viyana’da bir yaşam bilimleri danışmanlık firması olan Pharma Consultancy, Chen ve birçok müşterisinin, özellikle klinik araştırmalarda başarısız olduktan sonra rafa kaldırılmış bileşiklerin yeniden kullanılması söz konusu olduğunda, büyük ilaç şirketlerinden kısmen “kurumsal ego” ile karşı karşıya kaldıklarını belirtti. “Kimse bu yenilgiyi hatırlatmak istemez” diyor. İlaçları yeniden kullanmak isteyen kişiler, daha küçük başlangıçlardan daha fazla şansa sahip olan ve gelire ihtiyaç duyan ve başka bir projede daha fazla kapasiteye sahip olan bileşikler bulabilirler.
Mucke ayrıca, yeniden ilaçların doğrudan maliyet tasarrufunu abartmamanın önemli olduğunu belirtiyor. Bireysel bir proje için, uyuşturucu geri dönüşümü erken aşama geliştirme maliyetlerini azaltmaktadır, “fakat bu Faz II ve Faz III çalışmaları ile ilgili olarak çok fazla değildir.”
Uyuşturucu adayları için büyük veri toplayan araştırmacılar, sadece ticari zorluklarla değil, bilimsel olarak da karşılaşıyorlar. Bileşiklerin hücrelerde ve hayvan modellerinde gen ekspresyonunu nasıl etkilediğiyle ilgili tüm verilere rağmen, klinik araştırma hastalarındaki bu veriler eksiktir. MIT & Harvard Geniş Enstitüsü’nden Aravind Subramanian, “Mükemmel bir dünyada, hastalara tedaviden önce ve sonra ilaçlarla ve ifade profilleriyle muamele edeceğiz” diyor. O ve meslektaşları, Google’a biyolojik olarak aktif bileşikler için benzediği Bağlantı Haritası’nı (CMap) geliştirdiler. Örneğin, kullanıcılar bir hastalığın gen ifade modelini girebilir ve CMap bu deseni tersine çeviren sıralı bir bileşik listesi oluşturabilir. Şimdiye kadar, araç, ilaç adaylarını tanımlamak için yaklaşık 30 çalışmada kullanılmıştır, ancak veriler çoğunlukla hastalardan ziyade kanser hücrelerine dayanmaktadır.
Ayrıca, araştırmacılar, hastalıktaki gen ekspresyon örüntülerini tersine çeviren bileşikleri tanımlayabilmesine rağmen, mekanizmaları açığa çıkarmak daha zorlayıcıdır. UCSF’in Sirota’sı, “Çalıştıklarını görüyoruz, ancak neden her zaman olduğunu bilmiyoruz” diyor.
Büyük verilerden elde edilen uyuşturucu adayları henüz FDA onayını almamışlardır ve bu yaklaşımların sonuçta geleneksel yaklaşımdan daha iyi performans gösterip göstermeyeceği görülecektir. Yine de, Deshpande “son derece iyimser” olarak kalmaya devam ediyor. NuMedii’nin 2010’da başlamasından bu yana, uyuşturucu keşfine büyük veri yaklaşımları uygulayan başka girişimlerin de bir yeri olduğunu fark etti. Novartis ve GlaxoSmithKline gibi büyük ilaç şirketleri bile davrandı. “Birkaç uyuşturucu, bitiş çizgisine geçtikten sonra” büyük veri kullanarak, ilaç endüstrisi yaklaşımı daha geniş bir şekilde benimseyecek, diyor. “İlk günler, ancak umut verici hitlerimiz var.”
Hücre Hatları ve Daha Fazlası için Veri Madenciliği
Araştırmacılar aday bileşiklerini belirlediklerinde, büyük veri yaklaşımları, araştırmacıların adayları preklinik çalışmalarda doğru hücre çizgileri üzerinde test etmelerini sağlayarak ilaç geliştirme sürecini daha da hızlandırabilirler. Michigan Eyalet Üniversitesi’nden Bin Chen, ilaçların başarısız olmasının başlıca nedenlerinden biri olarak, grupların insanlarda doğru bir şekilde yansıtılmayan erken testler için hücre çizgilerini, doku modellerini ve hayvan modellerini seçtiğini söylüyor. Örneğin, araştırmacılar, iltihaplı hastalıkları incelemek için fareler kullanmış olsalar da, son zamanlarda yapılan bir çalışmada, bu farelerde inflamasyona karşı genomik tepkilerin, insanlarda inflamasyona karşı genomik tepkilerle iyi bir ilişki içinde olmadığı bulunmuştur (Proc. Natl. Acad. Sci. USA 2013, DOI. : 10.1073 / pnas.1222878110).
Chen, metastatik kanseri hedef alan bir ekibi yönetmektedir – kanser, orijinal tümörün ötesinde vücutta yayılmış olan kanserdir. Bazı çalışmalarda hücre tümörlerinin orijinal tümörde ne kadar yakın olduğunu yansıttığı düşünülse de, hiçbirinin hücre çizgileri metastatik kanseri modeline ne kadar yakından baktığına bakmadığı; Şimdiye kadar metastatik hastalık hakkında çok fazla veri bulunmuş ve bu tür çalışmalar zorlaşmıştır.
Halka açık verileri analiz etmek için yapay zekayı kullanan Chen’in ekibi, insan meme kanseri hücre dizilerinin gen ekspresyon profillerinin metastatik meme kanserli hastalardan alınan tümör örnekleri ile ne kadar iyi ilişkili olduğuna dair istatistiksel bir ölçüm geliştirdi. Bir ön çalışmada, 57 meme kanseri hücre dizisinin profillerini hastalardan alınan tümör örnekleri ile karşılaştırmış ve anlamlı farklar bulmuşlardır. Başka bir deyişle, metastatik meme kanseri ilaçları geliştiren araştırmacıların hücre çizgilerinin sınırlarını tanıması ve diğer klinik öncesi modelleri kullanması veya geliştirmesi gerekebilir.
İlaç firması NuMedii, bir ilacın farklı alt türlerini tanımlamak için yapay zeka veri madenciliği tekniklerini kullanarak ilaç geliştirme sürecinin daha erken aşamalarını düzene sokmak istemektedir. Tipik olarak, araştırmacılar, bir klinik araştırmadan sonra, alt tipler tanımlamak için kullanan ve kullanmayan hastalarda ilaca cevap veren hastalarda bulunan biyobelirteçleri karşılaştırarak alt tipler tanımlamaktadır. NuMedii’nin kurucusu ve CEO’su Gini Deshpande, “Bunu kafasına çevirmeye çalışıyoruz” diyor. “Farklı hasta altkümelerinde değişen moleküler mekanizmalar nelerdir, bu yüzden ilacı geliştirdiğini nereden biliyorsunuz?” NuMedii, idiopatik pulmoner fibrozisin alt tiplerini ayırmak için gen ekspresyon verilerini kullanmaya başladı.(Akciğerlerde skarlaşmaya neden olan kronik hastalıktır)
Kaynak : acs.org