Beyaz Altın: Lityum
| Atom numarası | 3 |
| Element Serisi | Alkali |
| Görünüş | Gümüş, beyaz gri |
| Atom ağırlığı | 6,941 g/mol |
| Yoğunluğu | 0,534 g/cm-3 |
| Erime Noktası | 180,54 oC |
| Kaynama Noktası | 1342 oC |
| Kristal Yapı | Kübik |
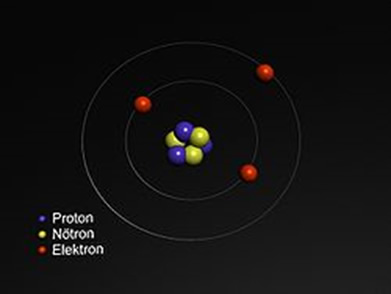
Lityum, sembolü Li atom numarası 3 olan bir elementtir. Periyodik tabloda 1. grupta alkali metal olarak bulunur ve yoğunluğu en düşük olan metaldir. Lityum doğada saf halde bulunmaz. Yumuşak ve gümüşümsü beyaz metaldir.
Havada bulunan oksijenle reaksiyona giren lityum, lityum oksit (Li2O) oluşturur. Hava ve su tarafından hızlı bir şekilde oksitlenip kararır ve lekelenir. Bu oksitlenme reaksiyonunu engellemek için lityum yağ içinde saklanır. Lityum metali doldurulabilir pillerde(örnek olarak cep telefonu ve kamera pili) ve ağırlığa yüksek direniş göstermesi sebebiyle alaşım olarak hava taşıtlarında kullanılır.
Lityum ilk olarak 1817 yılında Johan August Arfwedson tarafından keşfedilmiştir. İlk saf olarak izolasyonu ise William Thomas Brande ve Humphrey Davy tarafından lityum oksitin elektrolizi yolu ile gerçekleştirilmiştir. Spodumen cevheri ,LiAl(SiO3)2, Lityum içeriği nedeniyle ticari olarak çok önemlidir.
Lityum üzerine çalışmalar 1817 yılında başlamıştır. Lityum, sülfürik asit ile reaksiyona sokularak lityum sülfat (Li2SO4) elde edilir. Elde edilen bu çökelek, çözeltiden ayrılarak sodyum karbonat (Na2CO3) ile yıkanır. Böylece suda çözünmeyen lityum karbonat (Li2CO3) elde edilir. Lityum karbonat, lityumun kullanıldığı ürünlerde ana maddedir.
Doğada Lityum
Lityumun yeryüzündeki ortalama konsantrasyonu yaklaşık %0,006 oranında olup, deniz suyunda da yaklaşık 0,1 ppm lityum olduğu sanılmaktadır. Yaklaşık 150’den fazla lityum mineralinin varlığı bilinmesine rağmen, bunların çok azının ticari olarak önemi bulunmaktadır.
| Mineral | Formül | Teorik
% Li2O |
Ticari
% Li2O |
| Spodümen | LiAl(Si2O6) | 8,0 | 1,5-7 |
| Lepidolit | K2(LiAl)5-6(SiAlO).. | Değişken | 3-4 |
| Petalit | LiAl(Si4O10) | 4,9 | 3-4,5 |
| Ambylgonit | LiAl(PO4) | 10,1 | 8-9 |
Ticari Üretim
Li2SO3 + Na2CO3 → Na2SO4 + Li2CO3 (katı)
Elde edilen Li2CO3 çökeleği HCl ile reaksiyona sokularak LiCl elde edilir.
Li2CO3 + 2 HCl → 2 LiCl + CO2 + H2O
LiCl erime noktası 600 °C den fazla olduğu için elektroliz ile saflaştırılması zor olduğundan LiCl (55%) ve KCl (45%) karışımı kullanılarak erime noktası 430 °C’ye düşürülür. Bu karışımın elektrolizi ile Li saf olarak elde edilir.
- Katot: Li+(s) + e– → Li (s)
- Anot: Cl–(s) → ½ Cl2 (g) + e–
Lityum, bıçakla kesilebilen sodyumdan bir az daha sert olduğu için, onu kesmek veya bölmek çok daha zordur. Reaksiyona girmemiş Lityum gümüşümsü bir renge sahiptir, ancak kısa sürede rengi kararır. Düşük yoğunluğu sayesinde hidrokarbonlar üzerinde batmadan durabilir. Alev üzerine konulduğunda lityumda göz alıcı bir kırmızı renk gözlenir, ancak yanmaya başladığında parlak beyaz bir alev gözlemlenir. Lityum suda ve su buharında bulunan oksijen ile tutuşur ve yanma reaksiyonu gösterir.
Oda sıcaklığında azot ile reaksiyona giren tek metaldir. Yüksek özgül ısısı, 3582 J/(kg·K), ve sıvı haldeki geniş sıcaklık değerleri lityumu kullanışlı hale getirmektedir.
Lityum hava ve su ile yanması ve potansiyel patlama tehlikesine rağmen diğer alkali metallere göre daha az tehlikelidir. Oda sıcaklığındaki Lityum-Su reaksiyonu aktif ve çabuk gerçekleşen bir reaksiyon olmasına rağmen çok tehlikeli bir reaksiyon değildir. Lityum alevlerini söndürmek zordur ve bunun için özel kimyasallardan oluşan söndürücüler kullanılır.
Kullanım Alanları
Lityumun çok çeşitli endüstrilerde kullanım alanı bulunmakta olup; seramik, cam, alüminyum, yağ, eczacılık ve pil sektörü bunlar içerisinde en önemlilerindendir.
Ayrıca çeşitli metallerle alaşımlar da oluşturmaktadır (Li-Al, Li-Mg alaşımları).
Seramik sektöründe lityum karbonat ya da mineral olarak kullanılan lityum, erime sıcaklığının ve ısıl genleşme katsayısının düşmesini sağlarken, akışkanlığı da artırmaktadır. Cam üreticileri, beher ve şişe cam üretimlerinde lityumu kullanarak daha hafif ve daha ince kalınlığa sahip ürünler elde etmektedirler.
Lityum bileşikleri A vitamininin sentezinde ve manik (bipolar) depresif hastalığının tedavisinde kullanılmaktadır.
Elektrikli Otomobiller ve Yeşil Devrim
Devamlı artan ve hayal gücümüzün sınırlarını zorlayan müşteri istekleri nedeniyle ulaşımdan iletişime, sağlıktan savunmaya her alanda hızlı bir teknolojik tüketim yaşanmaktadır. Günümüzde hemen her bireyin hızlı, verimli ve kolay iletişim için taşınabilir elektronik aletlerden (bilgisayarlar, cep telefonları, kameralar, fotoğraf makinaları, MP3 çalarlar, CD çalarlar, DVD oynatıcılar, radyolar, televizyonlar) en az birisine sahip olduğu bilinmektedir. Gün geçtikçe elektrikli aletlerin çoğu kablosuz kullanılabilir hale gelmektedir. Bütün bu elektronik ürünlerin geliştirilen fonksiyonlarını uzun süreli ve etkin olarak idame ettirebilmeleri için temel şart yüksek enerji yoğunluğu, güvenilir ve uzun ömürlü, bakımı kolay, kısa sürede şarj edilebilen ve çevre dostu bir enerji kaynağına sahip olmasıdır.
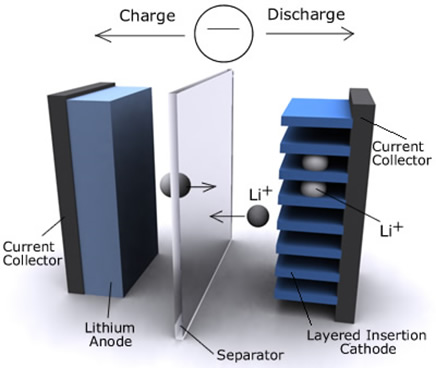
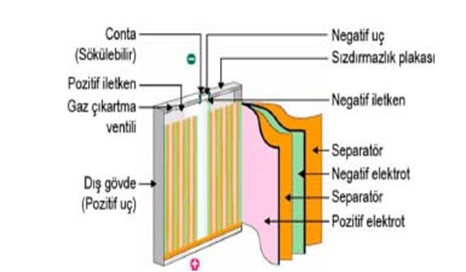
Şarj edilebilen/İkincil (Li-iyon) piller günümüzde taşınabilir elektronik ve elektrikli eşyalarda yaygın olarak kullanılmaktadır.
Avantajlar
- Kapalı hücre, bakım gerektirmez
- Uzun ömürlü ve tekrar kullanılabilir
- Geniş çalışma sıcaklığı
- Çabuk şarj edilebilme
- Yüksek enerji ve deşarj kapasitesi
Dezavantajlar
- Yüksek fiyat
- Yüksek sıcaklıkta bozunma
- Koruyucu devre ihtiyacı
- Aşırı şarj sonucunda kapasite kaybı ve termal bozunma
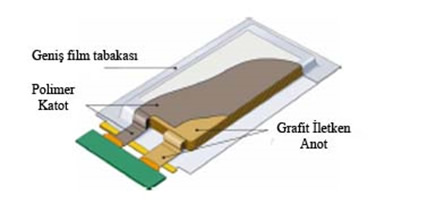
Lityum polimer piller
Organik elektrolit maddesi yerine polimer tipi elektrolit kullanılması ve bu suretle pil bünyesinde yer alan separatörlerin kaldırılması konusunda araştırmalar yapılmıştır. Li-polimer pillerde sıvı elektrolitin olmaması pilde sızma olayını ortadan kaldırmıştır, metalik dış kabı yerine alüminyum veya diğer tipte metal folyolar kullanılabilir.
Polimer uygulamasıyla üretim basitleşmiş, pil güvenliği artmış ve ince yapılı piller oluşturulmuştur.
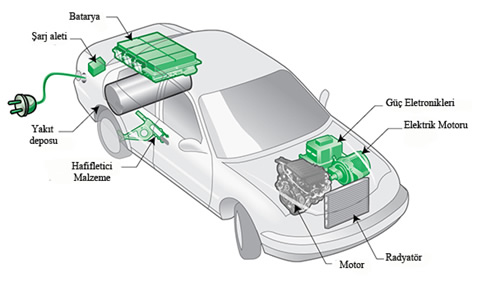
Elektrikli Araç Teknolojisi
Dünyada küresel ısınmaya neden olan karbon emisyonunun %20’den fazlası ulaşım sistemlerindeki enerji tüketiminden kaynaklanıyor. Arabaların tamamında kullanılan içten yanmalı motor teknolojisi bu oranda en büyük paya sahip etkendir.
Elektrikli araçlar, sıfır emisyonlu çevreye duyarlı araçlar olmaları nedeniyle petrol türevli araçlara göre daha cazibeli ve güçlü bir alternatiftir. Birincil enerji kaynağının aynı miktarına %60 daha fazla yol sürüşü sağlayan bu araçların enerji çevrimi de çok etkileyicidir. Elektrikli araçların sürüş mesafesi ise en önemli dezavantajlarından biridir.
Araçların menzilini arttırmak için batarya teknolojileri geliştirilmektedir. Yüksek enerji yoğunlukları, uzun raf ömrü ve düşük ağırlık küçük boyut avantajları nedeniyle lityum-iyon veya lityum-polimer bataryalar tercih edilmektedir.
Elektrikli araçların kullanılmaya başlanmasıyla,
- Ulaşım maliyetlerinin azaltılması,
- Fosil kaynaklı yakıtların kullanımın azalması,
- Özellikle CO2 salınımın ciddi oranda azalması, küresel ısınma ve ozon tabakasının rahatlaması
gibi çok önemli avantaj sağlayacaktır. Geleceğin teknolojisi olarak tanımlanan lityum-iyon pillerin özelliklerini geliştirmek dezavantajlarını gidermek için araştırmalar sürmektedir.
Ülkemizde araç mülkiyeti sayısının nüfusa oranı %15 seviyesinde olup, diğer ülkelere göre oldukça düşüktür. Elektrikli araçların Türkiye’de yaygınlaşabilmesi için öncelikli şart mevcut altyapının değişmesi ve şarj istasyonlarının yeterli sayıya ulaşmasıdır. Marmara bölgesi ve büyük şehirlerde 1000’e yakın akıllı şarj istasyonları kurmayı planlayan enerji sektörünün liderleri, 2020 yılında Türkiye araç parkının %19‘unu elektrikli araçların oluşturacağı ve elektrikli araç sayısının 4 milyonu aşacağı öngörülmektedir.
Enerji sektörü bunu söylese de kimya sektörünün daha buna hazır olduğunu söyleyemeyiz. Elektrikli araçların bataryaların, motorlarının ve güç jeneratörleri gibi parçalarının üretilmesi ve buna uygun sanayileşmenin zayıf olması Türkiye’de elektrikli aracın şimdilik bir rüya olduğu görülmektedir.
Teknoloji gün ve gün gelişmeye ve ilerlemeye devam ediyor. Enerjiniz tükenmesin!
Kaynaklar
- Deniz POLAT, Özgür KELEŞ,. İSTANBUL TEKNİK ÜNİVERSİTESİ METALURJİ BÖLÜMÜ, TEKNİK BÜLTEN.
- Lithium Ion Rechargeable Batteries, Technical Handbook.
- Fatma KILIÇ, Bazı Lityum metal vanadat içeren bileşiklerinin sentezi, karakterizasyonu ve elektrokimyasal özellikleri, Kahramanmaraş Üniversitesi Kimya Bölümü Yüksek Lisans Tezi, 2008.
- Tufan KAYIKLI, Abdülkadir BALIKÇI, A Lityum Polymer Battery Charger Design for Electric Vehicles, Gebze İleri teknoloji Enstitüsü.
- Wikipedia/Lithium
Yazar : İsmail BAYRAKTAR
Üniversite : Adnan Menderes Üniversitesi
Bölüm : Yüksek Kimyager
Dergi : Sayı 19– Sayfa 14