Kimyacılar Kırk Yıldır Kalıcı Olan Bu Sorunu Çözüyor!
Fotoğraf: Leiden Üniversitesi
Neredeyse kırk yıl sonra, kimyager Leiden ve Eindhoven yakıt hücreleri için gerekli olan heterojen katalizde en basit kimyasal reaksiyonla ilgili, doğru modelin oluşturulması hakkında süregelen tartışmayı çözdüler. Ludo Juurlink ve Leiden Üniversitesi’nde doçent olan Richard van Lent ve Hollanda Temel Enerji Araştırmaları Enstitüsü’nden (DIFFER) Michael Gleeson, eşsiz bir kavisli platin yüzey kullanarak, hangi modelin hidrojen reaksiyonunu doğru şekilde tanımladığını gösterdiler. Bulgularını 11 Ocak’ta Science dergisinde yayınladılar.
Kimya literatüründe, neredeyse kırk yıldır hararetli bir tartışma vardır: Hidrojenin bir platin katalizörle reaksiyonu için mevcut iki modelden hangisi doğrudur? Geleneksel yöntemler bunu kanıtlamak için yeterli değildi. Leiden Üniversitesi’nden Ludo Juurlink ve Hollanda Temel Enerji Araştırmaları Enstitüsü’nden (DIFFER) Michael Gleeson, başarılı olduğu ortaya çıkarılabilen kesin kanıtları sağlamak için yeni bir yöntem geliştirmeye karar verdiler.
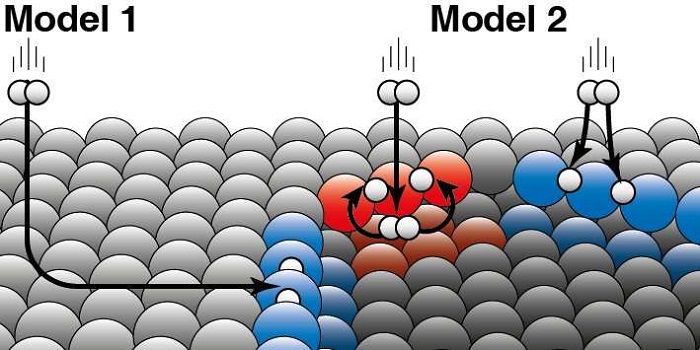
Heterojen kataliz için mevcut olan iki model, hidrojen reaksiyonunun platin yüzeyinin yapısına nasıl bağlı olduğu hakkında farklı tahminler vermektedir. Ölçümler yoluyla araştırmacılar hidrojenin reaktivitesini belirleyebilir ve böylece hangi modelin doğru olduğunu ispatlayabilirler. Kavisli platin kristal, ilk defa Hollandalı bir firma olan Zaandam’da yapıldığı için çok önemliydi. Julatlink, “Platin yüzeyi kavisli olduğu için, atom yapısı yüzey boyunca çok kademeli olarak değişiyor” diye açıklıyor. “Bu yapıyı, kenarlarına doğru gittikçe daralan basamakları olan bir merdivene benzetebilirsiniz. Ortada adeta bir balo salonu varmış gibi görünür” diye ekliyor. Bu durumda hidrojenin reaktivitesinin, adımların birbirine ne kadar yakın olduğuna bağlı olarak doğrusal bir şekilde değiştiğini ortaya çıkardılar. Yani adımlar ne kadar uzak olursa, o kadar az reaktif hidrojen olmuştur. Julatlink,“Öyleyse doğrusal olmayan bir davranışı öngören model yanlıştır” diyor.
Fotoğraf: Katalizör, kimyasal bir reaksiyonu hızlandırır ve reaksiyon sırasında tüketilmez. Heterojen katalizde, katalizör genellikle bir katıdır ve reaktanlar bir gaz veya sıvıdır. Juurlink iki model arasındaki farkı açıklıyor: İki model, hidrojen molekülündeki kinetik enerjinin platin yüzeyi ile çarpışma sırasında “nasıl sızdığı” konusunda farklı varsayımlara dayanıyor. Daha iyi anlaşılması için bir örnek veriyor: ‘Eğer bir köpek bir buz deliğinde duruyorsa, oraya iki şekilde gelmiş olabilir. Ya yandaki buzların üzerinden kayarak buz deliğinin içine düşmüştür ya da direk deliğin yanından içine atlamıştır.’ Araştırmaları, hidrojen moleküllerinin temel olarak platinin kenarındaki gaz fazından doğrudan reaksiyona girdiğini gösteriyor (Model 2). Model 1, çoğu molekülün düz platin yüzeyi üzerinde ‘kayarak’ kenarlarda durduğunu fakat daha sonra reaksiyona girdiğini varsayar. Bu nedenle bu yaklaşım doğru değildir. Araştırmacılar platin katalizörlerde doğal olarak meydana gelen iki farklı kenar türü (kırmızı ve mavi) arasındaki farkları gördüler. Hidrojen böyle bir kenarın üstüne veya altına inebilir. Her iki basamak kenarı türü için araştırmacılar, hangi kısmın doğrudan üst tarafa (mavi ile gösterildiği gibi) veya hangi kısmın ilk önce alt tarafa (kırmızı ile gösterildiği gibi) tepki gösterdiğine karar verebilirler.
Araştırma ultra yüksek vakumda gerçekleştirildi ve önemli bilgiler elde edildi. Juurlink, “Artık kimyasal reaksiyonların hızını nasıl hesaplayacağımızı biliyoruz (modellerden biri bu hesaba önemli ölçüde katkıda bulunmuyor). Ayrıca artık bu kavisli kristal yüzeylerin, bize benzersiz bir ürün sunduğunu biliyoruz. Bu, kimyasal reaksiyonların yüzeylerde gerçekte nasıl meydana geldiğini öğrenmek için yeni bir fırsat sunuyor. Bununla ilgili kesinlikle daha fazla araştırma yapacağız” diyor.
Neredeyse bütün büyük kimyasal endüstriyel proseslerde heterojen kataliz kullanır. Katalizörler bazen pahalı ve nadir olabilir. Örneğin yakıt hücrelerinde ve araç egzoz sistemlerinde bulunan ortak bir katalizör olan platin pahalı ve nadir olan bir katalizör çeşididir. Juurlink, “Sıra dışı olan şey, genellikle bu katalizörlerin kimyasal reaksiyonları nasıl ve neden hızlandırdığını gerçekten biz de bilmiyoruz. Bunun daha iyi anlaşılması, kimya endüstrisinin daha sürdürülebilir hale getirilmesinde nasıl ve neden katkıda bulunacağını açıklar. Atom düzeyinde neler olup bittiğini daha iyi anlayıp buna dayanarak yeni katalizörler geliştirebiliriz. Daha az enerji kaybına neden olan ve pahalı ve nadir malzemelere daha az bağımlı olan katalizörler geliştirmek temel hedefimizdir” diyor.
Kaynak : phys.org