Proteinlerin Yapı Taşı Aminoasitler
Aminoasitler, aynı karbon atomuna hem karboksil hem de amin gruplarının bağlanması ile oluşan küçük hacimli moleküllerdir (Şekil 1)1.
Şekil 1. Aminoasit moleküllerinin yapısı
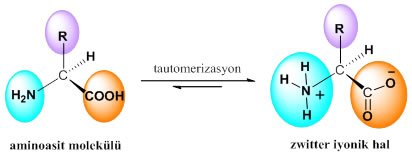
Nötral ortamlarda zwitter iyonik yapıda bulunurlar. Zwitter iyonik yapı, karboksil grubundaki hidrojen atomunun proton olarak ayrılması ve amin grubuna bağlanması ile oluşan yapıdır. Aminoasitin zwitter iyonik forma dönüşümü tautomerizasyon olarak adlandırılabilir. Tautomerizasyon, organik moleküldeki bir atomun molekül içindeki göçünü ifade etmektedir. Zwitter iyonik form ve zwitter iyonik forma dönüşmeyen bu iki yapı ise birbirinin tautomeridir. Aminoasitlerin doğasında zwitter iyonik halde bulunma isteği vardır ve bu halde kararlıdırlar (Şekil 2)2.
Şekil 2. Aminoasitlerin tautomerleşmesi ve zwitter iyonik yapı
Şekil 2’de görülen aminoasitlerin genel yapısındaki R grubu alkil grubu olup, değişken gruplardır. Alkil grubu değiştikçe amino asidin türü de değişmektedir. Proteinlerin yapısını oluşturan 20 çeşit amino asit vardır. Bu aminoasitlerden 10 tanesi temel amino asitlerdir ve insan vücudu bunları sentezleyemedikleri için dışarıdan alması gerekmektedir. Geri kalan 10 tanesi ise insan vücudunda ihtiyacı karşılayacak miktarda sentezlenmektedir (Tablo 1)3.
| İnsan vücudundasentezlenen
aminoasitler |
Sembolü | İnsan vücudundasentezlenemeyen aminoasitler | Sembolü |
| Alanin | A | İzolösin | I |
| Asparajin | N | Lösin | L |
| Aspartik asit | D | Lizin | K |
| Sistein | C | Metiyonin | M |
| Glütamik asit | E | Fenilalanin | F |
| Glütamin | Q | Treonin | T |
| Glisin | G | Triptofan | W |
| Prolin | P | Valin | V |
| Serin | S | Arjinin | R |
| Tirozin | Y | Histidin | H |
Tablo 1. Aminoasit türleri ve standart sembolleri
Aminoasitler kendi içinde küçük ve büyük hacimli, yüklü, nötral, kükürt atomu içeren, aromatik, alifatik, hidrofobik, hidroksi grubu içeren, asidik ve bazik gibi gruplandırılmaktadır (Şekil 3).
Şekil 3. Aminoasitlerin gruplandırılması
Sistein, histidin, tirozin ve arjinin özellikle çocuklarda alınması zorunlu olan aminoasitlerdir. Çünkü çocukluk döneminde bu aminoasitlerin sentezini gerçekleştiren metabolik reaksiyonlar çok zayıftır4.
Aminoasitler biyolojik olarak aktif moleküllerdir ve sahip oldukları R grubunun türüne bağlı olarak farklı biyolojik aktivite göstermektedirler. Biyolojik bir katalizör olan ve canlı metabolizmasında meydana gelen reaksiyonların daha hızlı olmasını sağlayan enzimler için aktivatör (enzim aktivitesini artıran) veya inhibitör (enzim aktivitesini azaltan) olarak görev yapabilmektedirler5.
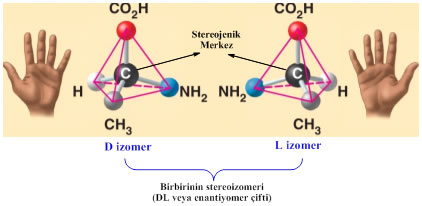
Birbirinin stereoizomeri (enantiyomer) olan aminoasitlerden sadece biri enzimler için aktivatör olarak görev yaparken, diğeri inhibitör olarak görev yapmaktadır. Enantiyomerlerin, biyolojik aktivite dışındaki tüm fiziksel ve kimyasal özellikleri aynıdır. Enantiyomer, ayna görüntüsü ile üst üste çakışmayan moleküllerdir. Molekülün ayna görüntüsü ile üst üste çakışmaması için bir stereojenik karbona (dört farklı grubun bağlı olduğu karbon) ihtiyaç vardır. Aminoasitler için enantiyomer çifti kavramı yerine DL çifti kavramı daha sıklıkla kullanılmaktadır. D ve L izomeri aminoasitteki amin grubunun sağda ya da solda olması ile ilgili bir durumdur (Şekil 4)6.
Şekil 4. Aminoasitlerde DL çifti
Enzimler, birçok organik reaksiyonun gerçekleştiği aktif bölgelere sahiptir. Bu aktif bölgeler, aktivatör-inhibitör ve reaksiyona girecek kimyasal maddelerle (substrat) yapısal uyuma (anahtar-kilit) sahiptir. Özellikle aminoasitler enzimlerin aktif bölgeleri ile etkileşerek canlı organizmalarda meydana gelen bazı metabolik reaksiyonların daha hızlı gerçekleşmesini ya da durdurulmasını sağlamaktadır (Şekil 5)7.
Şekil 5. DL aminoasit çiftlerinin enzimlerle etkileşme durumları
Kaynaklar :
- Hudaky, P., Beke, T., Perczel, A., Journal of Molecular Structure (Theochem), 2002, 583, 17-135.
- Dinakar, C., Djilianov, D., Bartels, D., Plant Science, 2012, 182, 29-41.
- Kyte, J., Doolittle, R.F., Mol. Biol., 1982, 157,105-132.
- Imura, K., Okada, A., Nutrition,1998, 14 (1), 143-8.
- Bairoch, A., Nucleic Acids Res.,2000, 28, 304-305.
- Conteras, R., Flores-Parra, A., Lopez-Sandavol, H.C., Barba-Behrens, N., Coordination Chemistry Reviews, 2007, 251, 1852-1867.
- Lewis, D., Wiseman, A., Enzyme and Microbial Technology, 2005, 36, 377-384.
Yazar : Düzce Üniversitesi Öğretim Üyesi Yard. Doç. Dr. Haydar GÖKSU
Üniversite : Atatürk Üniversitesi
Bölüm : Kimya Öğretmeni
Dergi : Sayı 16– Sayfa 10