SARS-CoV-2 İnsan Hücresel Alarm Sistemini Nasıl Etkisiz Hale Getirir?
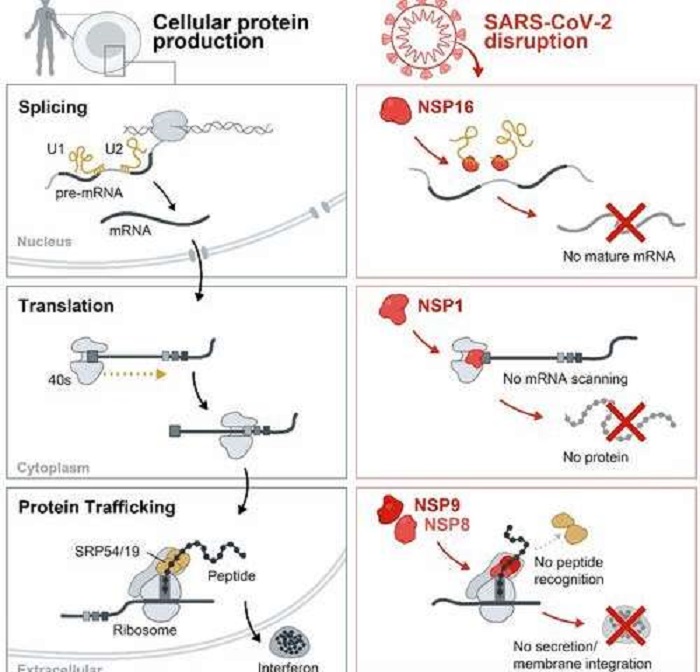
Fotoğraf : SARS-CoV-2’nin bu süreçleri nasıl bozduğuna (sağ sütun) kıyasla sağlıklı hücresel protein üretiminin (sol sütun) bir grafiği. Virüs, hücrenin bir enfeksiyon sırasında yardım istemesini önlemek için uçbirleştirme, çeviri ve protein trafiği süreçlerini bozar.
Tüm dünyada yarım bir yıldan fazladır süre gelen COVID-19 salgınında doktorlar ve araştırmacılar, hastalığın diğerleri arasında öksürük, ateş, nefes darlığı ve yorgunluk gibi görünen ana semptomlarının ne olduğu konusunda oldukça iyi fikirlere sahipler. Ancak, semptomların tedavisi için eşit derecede önemli olan, COVID-19’a sebep olan koronavirüsün ve SARS-CoV-2’nin insanları bu denli hasta etmek için insan hücreleri içinde ne yaptığını anlamaktır.
Diğer bütün virüsler gibi SARS-CoV-2 bir hücre içine girer ve daha fazla virüs oluşturmak için kaynaklarını ve mekanizmalarını ele geçirir. Evrimsel olarak konuşursak başarılı virüsler, efektif bir şekilde bir hücrenin savunmasından kaçabilen, ancak hücreyi tamamen öldürmekten kaçınan virüslerdir. (Sonuçta virüsün çoğalabilmesi için canlı kalması gerekir.)
İnsan hücreleri (ve, daha geniş olarak memeli hücreleri) viral enfeksiyonlar ile başa çıkmak için sabit savunma mekanizmalarına sahiptirler. Mevcut viral genetik materyaller, bir hücrede interferon olarak adlandırılan bir grup proteinin üretilmesine ve salgılanmasına yol açan, enfeksiyonu sonlandırmaya ve komşu hücrelere tehdidi bildirmeye çalışan bir dizi olayı tetikler. Araştırmacılar, şiddetli derecede Kovid-19 semptomları olan hastaların ayrıca düşük seviyelerde interferon yanıtı gösterdiğini bulmuş ve bu da interferon yanıtının virüsler ile mücadelede çok önemli olduğunu düşündürmüştür. Peki virüsler bu normal savunma mekanizmalarını nasıl ortadan kaldırır?
Kaliforniya Teknoloji Enstitüsü (Caltech) araştırmacıları tarafından yönetilen bir ekip, SARS-CoV-2 virüsünün insan hücrelerini etkisiz hale getirdiği mekanizmaları saptadı, temelde hücrenin alarm sistemini devre dışı bıraktı, böylece yardım çağıramaz veya enfeksiyonun yakınındaki hücreleri uyaramaz hale geldi. Virüsün hücresel düzeyde nasıl fonsiyonel bozukluğa sebep olduğunu anlamak, onunla nasıl savaşılacağına dair içyüzünü anlamada yeni bilgiler verir.
Araştırma, öncelikle biyoloji profesörü ve Heritage Medical Research Institute araştırmacısı Mitchell Guttman’ın laboratuvarında gerçekleştirildi. Akademik dergi olan Cell’de yayınlanmadan önce, araştırmayı açıklayan bir makale çevrimiçi olarak yayınlandı.
SARS-CoV-2 virüsü yaklaşık 30 viral protein üretir. Bu yeni araştırmada, Guttman laboratuvarı bunların her birini gözlemledi ve bir laboratuvar tabağında yetiştirilen insan hücrelerindeki moleküler bileşenler ile nasıl etkileşime girdiklerini haritaladı. SARS-CoV-2 proteinlerinin, insan protein üretimini bozmak için üç tane kritik hücresel sürece saldırdıklarını buldular.
Vermont Üniversitesi’nde bilim insanı ve makalenin ilk yazarlarından olan Emily Bruce, “virüsler muhteşemdir” diyor. Sözlerine, “virüsler ve konakçı hücreler, durmaksızın birbirlerini alt etmek için evrimsel bir silahlanma yarışındadır. SARS-CoV-2, hücreleri tamamen öldürmeden devre dışı bırakmanın karmaşık ve spesifik yollarını geliştirdi, böylece virüs hücreyi kendi amaçları için kullanmaya devam edebilir” ekleme yaptı.
Temel hücre biyoloji geçmişinde ilk olarak: Hücrenin çekirdeği, DNA olarak yazılan genetik materyalini barındırır. Bu sözde genom, kapsamlı bir kullanım kılavuzu ile örneğin, “Nasıl Bir Sinyal Gönderilir” veya “Viral Enfeksiyon Durumunda Ne Yapmalı” gibi başlıklı “bölümler” olarak düşünülebilir. Hücrenin geri kalanı, bu talimatları gerçekleştiren proteinleri (örneğin interferon) oluşturan mekanizmayı içerir.
DNA’nın talimatlarını faydalı proteinlere dönüştürme süreci biyolojinin “merkezi dogması” olarak adlandırılır. İlk adım, hücre çekirdeğindeki bir DNA parçasının okunduğu ve çekirdeği terk edip hücrenin geri kalan kısmına gidebilen bir forma (mRNA olarak adlandırılan bir molekül) kopyalandığı transkripsiyondur.
mRna çekirdeğin dışına verildikten sonra, hücresel mekanizmanın bir parçası olan ribozom olarak adlandırılan olgun mRNA’ya bağlanır, onu okur ve çeviri adı verilen bir işlem ile (orta sıra) karşılık gelen proteini oluşturur.
Bu proteinlerin bazıları, diğer hücrelere mesajları iletmesi için kaynak hücrenin dışına hareket edeceği şekilde, örneğin mevcut bir viral enfeksiyon hakkında uyarmak için tasarlanmıştır. Bu durumda, sinyal teşhis parçacığı olarak adlandırılan bir diğer hücresel mekanizmanın parçası devreye girer; bir çeşit ulaştırma sistemi gibi çalışır, proteinlerin bir hücrenin içinden dışına doğru hareketine yardımcı olur. Bu da protein trafiği (alt sıra) olarak bilinir.
Guttman laboratuvarı, SARS-CoV-2 proteinlerinin tüm bu süreci birden çok aşamada engellediğini keşfetti. Virüs proteinlerinden bazıları mRNA’nın tam olarak eklenmesini ve uygun bir şekilde birleşmesini engeller. Diğerleri ribozomu tıkar, böylece yeni proteinler oluşamaz. Yine diğer SARS-CoV-2 proteinleri, sinyal teşhis parçacığına müdahale eder ve protein taşınmasını engeller.
Ribozomu tıkayan protein NSP1 olarak adlandırılır. Ekip, önemli bir biçimde, NSP1’in insan mRNA’sının ribozoma girişini engellediğini, ancak viral mRNA’nın girişine gayet iyi bir şekilde izin verdiğini buldu. Viral mRNA, mRNA’larının her birinin başında bir erişim kodu gibi davranan, viral proteinler yapmak için ribozomu etkili bir şekilde ele geçiren ancak insan proteinleri yapmayan genetik bir imza içerir. Çünkü viral üretimi bu imzaya bağlıdır ve anti-viral terapötik gelişim için güçlü bir hedef oluşturabilir.
Guttman, “SARS-CoV-2’nin bozduğu süreçlerin her biri – uçbirleştirme, çeviri ve protein trafiği – insan genetik materyalini proteinlere dönüştürmek adına ve insan biyolojisi için çok önemlidir. Doğrusu, bu süreçlerin her birinin ayrı ayrı keşfi, bir Nobel Ödülü verilmesine yol açtı. Bunlar hayatın merkezinde olan makinelerdir. Onlar olmadan var olamayız. SARS-CoV-2, bu hücresel makineleri etkisiz kılmak ve onların fonksiyonlarını bozmak için çok özel yollar ile gelişti” dedi.
Guttman laboratuvarında yüksek lisans öğrencisi ilk ortak yazar Abhik Banerjee, “Temel bilim araştırmasının önemini, çalışmamız örnekler ile açıklıyor ve gelecekte yeni ortaya çıkacak RNA virüslerini ele almak için bir boru hattı oluşturuyor. Ek olarak, Kaliforniya Teknoloji Enstitüsü’ndeki bilim camiasının diğer yerlerindeki işbirlik içinde olan bilim atmosferini en iyi haliyle göstermektedir. Burada, Kaliforniya Teknoloji Enstitüsü’nde profesörlere, Rebecca Voorhees (yayınlanan makalenin ortak yazarı da dahil olmak üzere) biyolojinin çeşitli temel alanlarındaki liderlere erişebiliyoruz. Bil Clemons ve Shu-ou Shan yapısal biyolojide, hepsi verilerimizin sonuçlarını tartışmaya ve nispeten bu yeni alanda bizim için uzmanlık sağlamaya istekliler” dedi.
Guttman laboratuvarında araştırma görevlisi olan Mario Blanco da aynı fikirde.
Blanco, “SARS-CoV-2 proteinlerinin insan RNA’sının hedeflerini sorgulama yeteneğimiz, kanıt olmaksızın bu mekanizmaları önceden tanımlamak için bize izin verdi. Burada geliştirdiğimiz metotlar ve uygulamalar, bu süreçlerde meydana gelecek benzer hastalıklara ve mekanizma hakkında derinlemesine bir anlayışa sahip olmadığımız hala mevcut olan virüslere uygulamak için bize izin verecek” dedi.
Makalenin başlığı “SARS-CoV-2, Konakçı Savunmalarını Ortadan Kaldırmak İçin Uçbirleştirme, Çeviri Ve Protein Trafiğini Bozuyor”oldu.
Kaynak : phys.org