mRNA Aşılarının Karışık Tarihi
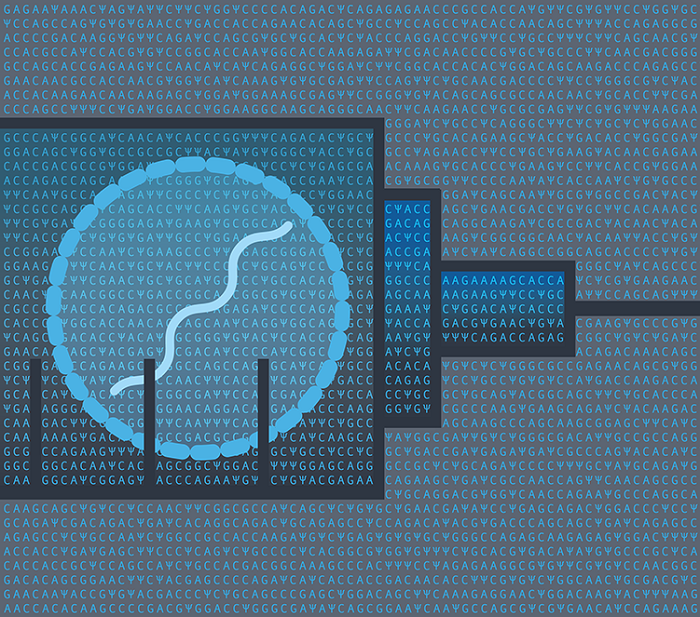
Fotoğraf-1: Pfizer ve BioNTech tarafından Covid-19 aşılarının geliştirilmesinde kullanılan RNA sekansı( urüdin nükleotidinin modifiye edilmiş formu olan Ψ). Credit: Nik Spencer/Nature
1987 yılının sonlarına doğru, Robert Malone bir dönüm noktası olan deneyini gerçekleştirdi. Bir tür moleküler güveç oluşturmak için; mRNA ipliklerini yağ damlacıklarıyla karıştırdı. Bu genetik karışımla yıkanan insan hücreleri, karışımın içeriğinde bulunan mRNA’yı absorbe etti ve ilgili proteinleri üretmeye başladı.
Kaliforniya, La Jolla’daki Salk Biyolojik Araştırmalar Enstitüsü’nde yüksek lisans öğrencisi olan Malone, bu keşfin tıpta oldukça geniş ve kapsamlı bir potansiyele sahip olabileceğini fark ederek, imzalayıp tarih attığı bazı notlar aldı. Eğer mRNA verilen hücreler ilgili proteinleri üretebilseydi, 11 Ocak 1988’de aldığı bir notta da belirttiği üzere “RNA’nın bir ilaç olarak ele alınması” mümkün olabilirdi. Salk laboratuvarının bir başka üyesi de gelecek nesiller için kıymetli olan bu notları imzaladı. Aynı yıl içerisinde, Malone deneylerini, kurbağa embriyolarına mRNA’ları yağ damlacıklarıyla absorbe ettirdi. Bu yaklaşım ile ilk defa, mRNA’nın canlı bir organizmaya geçişini kolaylaştırmak için yağ damlacıklarını kullanılmıştı.
Bu deneyler, tarihin en önemli ve karlı aşılarından ikisine doğru bir basamak oluşturdu: Dünya çapında yüz milyonlarca insana uygulanan mRNA tabanlı COVID-19 aşıları. Bu mRNA tabanlı aşıların küresel satışlarının yalnızca 2021’de 50 milyar ABD dolarını aşması bekleniyor.
Ancak başarıya giden yol doğrudan ve kolay değildi. Malone’un diğer araştırmacıların çalışmalarından yararlanarak gerçekleştirdiği deneylerden sonra hala mRNA bir ilaç veya aşı olarak kullanılamayacak kadar kararsız ve pahalı görüldü. Buna rağmen düzinelerce akademik laboratuvar ve şirket, mRNA aşılarının yapı taşları olan doğru yağ ve nükleik asit formülünü bulmak için yoğun çalışmalar yaptı ve bu fikrin geliştirilmesi üzerinde çalıştı.
Günümüzün mRNA aşıları, kimyasal olarak değiştirilmiş RNA ve onları hücrelere taşımaktan sorumlu farklı yağ kabarcıkları da dahil olmak üzere Malone’un laboratuvardaki zamanından yıllar sonra icat edilmiş yeniliklere sahip. Yine de kendisine “mRNA aşılarının mucidi” diyen Malone, çalışmalarına yeterince itibar edilmediğini düşünüyor ve bu durumu Nature’a “Ben tarihin dışında kaldım” şeklinde açıklamıştır.
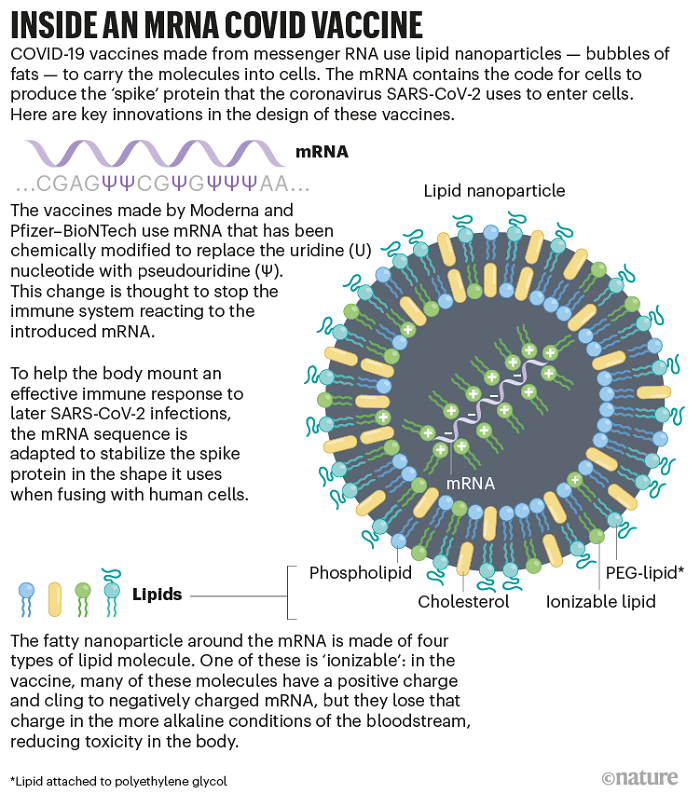
Fotoğraf-2: Nik Spencer/Nature; M. D. Buschmann et al. Vaccines 9, 65 (2021)’den uyarlanmıştır.
Teknolojiye öncülük ettiği için övgüyü kimin hak ettiği konusundaki tartışmalar, ödüller dağıtılmaya başladıkça kızışıyor. Ancak yalnızca birkaç bilim insanı ile sınırlı olan bu resmi ödüller, mRNA’nın tıbbi gelişimine katkıda bulunan birçok kişiyi karanlıkta bırakacaktır çünkü, mRNA aşılarına giden yol, 30 yılı aşkın süredir yüzlerce araştırmacının çalışmalarına dayanmakta.
Hikaye, birçok bilimsel keşfin yaşamı değiştiren yeniliklere dönüşme şeklini aydınlatıyor: Onlarca yıllık çıkmaz sokaklar, reddedilmeler ve potansiyel kârlar için verilen mücadeleler, aynı zamanda cömertlik, merak, şüphecilik ve şüpheye karşı inatçı ısrar. Tucson’daki Arizona Üniversitesi’nden bir gelişim biyoloğu olan ve 1980’lerin ortalarında bu alana yönelik kendi katkısını yapmış Paul Krieg, “Bu, uzun bir yol ve milyonlarca dizi adımdan oluşuyor ve neyin yararlı olacağını asla bilemezsiniz” diyor.
mRNA’nın Başlangıcı
Malone’un deneyleri birdenbire ortaya çıkmadı. 1978’e kadar bilim insanları, protein ekspresyonunu indüklemek için mRNA’yı fare ve insan hücrelerine taşımak için lipozom adı verilen lipitten oluşan bir zar yapısına sahip kesecikleri kullanmıştırlar. Lipozomlar sahip oldukları bu görevi; iç kısmında paketlenmiş ve koruma altındaki mRNA’yı hücre zarlarına kaynaşarak aktarmaktadır. Ancak yapılan bu deneyler, lipozomlar ve mRNA’lar ile yıllarca süren uzun çalışmalara dayanıyordu ve her ikisi de 1960’larda keşfedilmişti.
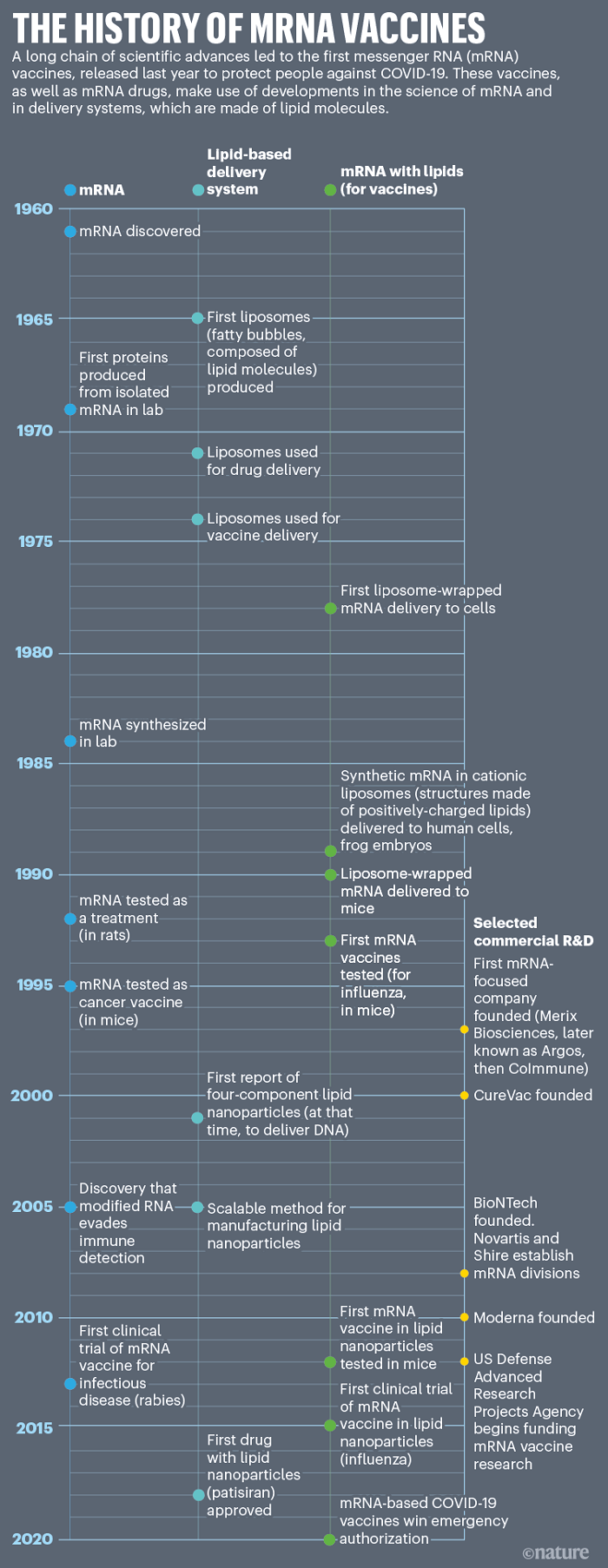
Fotoğraf-3: Nik Spencer/Nature; U. Şahin et al. Nature Rev. Drug Discov. 13, 759–780 (2014) and X. Hou et al. Nature Rev. Mater. https://doi.org/gmjsn5 (2021)’ den uyarlanmıştır.
Ancak o zamanlar çok az araştırmacı mRNA’yı tıbbi bir ürün olarak düşünmüştü fakat bunun nedeni bu genetik materyalin laboratuvarlarda üretilmesinin henüz bir yolunun olmaması değildi, bu moleküllerin asıl kullanım amacı, temel moleküler süreçlerin keşfedilmesi ve sorgulanmasıydı. Çoğu bilim insanı mRNA’yı başka bir amaca uygun hale getirebilmek amacıyla, tavşan kanından, kültürlenmiş fare hücrelerinden veya başka bir hayvansal kaynaktan elde etmekteydi.
Bu bakış açışı, 1984’te, Massachusetts’teki Harvard Üniversitesi’nden moleküler biyologlar Tom Maniatis, Michael Gree ve gelişimsel biyolog Douglas Melton ve çalışma grubundaki diğer moleküler biyologlar tarafından yönetilen ekibin: RNA-sentez enziminin (bir virüsten alınan) laboratuvarda biyolojik olarak aktif mRNA üretimi için kullanmasıyla değişti. Krieg daha sonra laboratuvar yapımı mRNA’yı kurbağa yumurtalarına enjekte etti ve bunun tıpkı gerçek endojen bir mRNA gibi çalıştığını gösterdi.
Hem Melton hem de Krieg, sentetik mRNA’yı esas olarak gen işlevi ve aktivitesini incelemek için bir araştırma aracı olarak gördüklerini belirtmiştirler. 1987’de Melton, mRNA’nın protein üretimini hem aktive etmek hem de önlemek için kullanılabileceğini keşfettikten sonra, sentetik mRNA’yı bloke etmek için kullanmanın yollarını araştırmak için Oligogen (daha sonra Gilead Sciences, Foster City, California’da yeniden adlandırıldı) adlı bir şirketin kurulmasına yardımcı oldu. Şirketin geliştirdiği aşıların asıl amacı hedef genlerin ifadesi ile hastalığın tedavi edilmesiydi ancak bu amaç şirkete bağlı araştırmacıların ve ortak çalışanların aklının ucundan bile geçmiyordu.

Fotoğraf-4: Laboratuvarda mRNA sentez yolları üzerinde çalışan Paul Krieg (sol) ve Douglas Melton (sağ).Credit: University of Arizona; Kevin Wolf/AP Images for HHMI.
Krieg, “Genel olarak RNA, inanılmaz istikrarsızlıklarından dolayı kötü bir üne sahipti. RNA’nın etrafındaki her şey dikkatle gizlenmişti” diyor. Krieg’in bu sözleri, Harvard Teknoloji Geliştirme ofisinin neden grubun RNA sentezi yaklaşımının patentini almamayı seçtiğini açıklar nitelikte. Harvardlı araştırmacılar bu keşfin patentini almak yerine, Wisconsin Madison’deki bir laboratuvar malzemeleri şirketi olan ve RNA sentez araçlarını araştırmacıların kullanımına sunan Promega Corporation’a verdi. Bu keşif mütevazı bir telif ücreti ve karşılığında bir kasa Veuve Clicquot Şampanya yeni sahiplerini bulmuş oldu.
Patent Anlaşmazlıkları
Malone yıllar sonra yaptığı deneylerde, Harvard ekibinin deneylerinde izlediği mRNA sentez yöntemlerini izledi fakat yaptığı çalışmaya pozitif yük taşıyan ve malzemenin negatif yüklü mRNA omurgasıyla bağlantı kurma yeteneğini artıran yeni bir tür lipozom ekledi. Bu lipozomlar, şu anda California Üniversitesi, Irvine’deki Aşı Araştırma ve Geliştirme Merkezini yöneten bir biyokimyacı olan Philip Felgner tarafından geliştirilmiştir.

Fotoğraf-5: Philip Felgner(sol) ve Robert Malone(sağ). Credit: Steve Zylius/UCI; Robert Malone
Malone, mRNA’nın insan hücreleri ve kurbağa embriyoları tarafından absorbe edilmesi için lipozomları kullanmış ve başarılı sonuçlar elde etmiş olmasına rağmen, hiçbir zaman doktora derecesi kazanamamıştır. Salk Enstitüsünde gen terapisi alanında araştırmacı ve aynı şekilde Malone’un danışmanı olan Inder Verma ile arası bozuldu ve 1989’da, San Diego, California’da yeni kurulan bir şirket olan Vical’de Felgner için çalışmak üzere lisansüstü çalışmalarını erken bir vakitte bıraktı. Malone’nin yeni şirketi ve Wisconsin-Madison Üniversitesi’ndeki araştırmacıların yürüttüğü çalışma; lipid-mRNA komplekslerinin farelerde protein üretimini teşvik edebileceğini göstermiştir.

Fotoğraf-6: Robert Malone’nun 1989 yılında mRNA’nın sentezlenmesi ve farelere enjeksiyonunu anlatan laboratuvar notlarından alıntı. Credit: Robert Malone
Bu buluşun hemen ardından işler karıştı. Hem Vical (Wisconsin Üniversitesi ile birlikte) hem de Salk Enstitüsü, Mart 1989’da patent başvurusunda bulundu. Ancak Salk Enstitüsü kısa süre sonra patent talebinden vazgeçti ve 1990’da Inder Verma, Vical’in danışma kuruluna katıldı.
Malone’e göre, Verma’nın patent talebini geri çekmesi ve Vical’in ilgili fikri mülkiyetin tamamını almasının, bir kulis oyunu olabileceğini düşünüyor. Malone, bu buluşun keşfedilmesinde rol alan birkaç kişinin bulunduğu listele yer alıyor ancak Salk Enstitüsü tarafından verilen herhangi bir patentten veya sonraki lisans anlaşmalarından kişisel olarak kâr elde edemiyor. Malone’un yaşadığı bunca şeyden sonra vardığı sonuç: “Aklımın ürünleriyle zengin oldular” şeklinde.
Verma ve Felgner, Malone’un suçlamalarını kategorik olarak reddediyor. Verma’nın bu konuya yönelik Nature’a yaptığı açıklama “Bu tam bir saçmalık. Patent başvurusunu düşürme kararı Salk’ın teknoloji transfer ofisine ait” şeklinde.
Malone, Ağustos 1989’da Vical’dan ayrıldı ve sebep olarak Felgner ile “bilimsel yargı” ve “entelektüel katkılarıma verilen değer” konusundaki anlaşmazlıklarını gerekçe gösterdi. Tıp fakültesini bitirdi ve bir yıllık klinik eğitim aldı ve aynı zamanda akademide mRNA aşıları üzerine araştırma yapmaya devam etmek için finansman aramayı da sürdürdü lakin finansman bulma çalışmaları başarısız oldu ve mRNA aşırlarını araştırmak yerine DNA aşılarına ve dağıtım teknolojilerine odaklandı.
Malone 2001 yılında ticari işlere ve danışmanlığa geçti. Malone’un araştırmaları sayesinde olanaklı hale gelen mRNA aşıları covid-19 sebebiyle kullanılmaya başlanmıştır ve Malon aşıların güvenliğine alenen karşı. Malone, aşılar tarafından üretilen proteinlerin vücut hücrelerine zarar verebileceğini ve aşının risklerinin çocuklar ve genç yetişkinler için yararlarından daha fazla olduğunu, diğer bilim insanlarının ve sağlık yetkililerinin Malone’un açıkladığı bu riskleri defalarca reddettiğini iddia ediyor.
Üretim Zorlukları
1991 yılında Vical, dünyanın en büyük aşı geliştiricilerinden biri olan ABD firması Merck ile milyonlarca dolarlık bir araştırma işbirliği ve lisans anlaşması imzaladı. Merck’in bünyesindeki bilim insaları, bir grip aşısı oluşturmak amacıyla farelerde mRNA teknolojisini değerlendirdi, ancak daha sonra bu yaklaşımı rafa kaldırdılar. Eski bir Merck çalışanı ve aşı araştırmalarında şirteklerin konu danışmanlığını yapan Jeffrey Ulmer bu konuya yönelik “Üretimin maliyeti ve fizibilitesi bizi biraz duraklattı” diyor.
Fransa’nın Strasbourg kentinde bulunan Transgène adlı küçük bir biyoteknoloji firmasındaki araştırmacılar da aynı şekilde hissetmiş ve çalışmalarına son vermiştir. 1993 yılında, Pierre Meulien liderliğindeki bir ekip, endüstriyel ve akademik ortaklarla yürüttükleri bir çalışmayla, bir lipozomun içinde ki mRNA’nın farelerde spesifik antiviral bağışıklık sisteminde bir elisitör olarak görev yapabileceğini ilk kez ortaya koydu. Bu araştırmaya benzer bir başka heyecanlı keşif ise; 1992 yılında La Jolla Scripps Araştırma Enstitüsünde ki bilim insanlarının, şıçanlardaki bir proteinden kaynaklı metabolik bozukluğun tedavisinde, direkt olarak proteinin kullanımı yerine mRNA kullanılmasıydı. Fakat bu gibi bir çalışmanın bağımsız laboratuarlar tarafından yapılarak benzer bir başarıyla sonuçlanması ve sonuçların bildirilmesi neredeyse yirmi yıl almıştır.
Bu transgen çalışmasındaki araştırmacılar buluşlarının patentini aldılar ve mRNA aşıları üzerinde ki çalışmalarına devam ettiler. Ancak şu anda Brüksel merkezli bir kamu-özel kuruluşu olan Innovative Medicines Initiative ‘nin başkanı olan Meulien, ilgili çalışma platformunu optimize etmek için en az 100 milyon Euro’ya (119 milyon ABD Doları) ihtiyaçlarının olduğunu ve bu kadar risk taşıyan bir konuda bütçe almak için yöneticilere bunu sormayı bile düşünmediğini söylüyor. İlgili patent, Transgène’in ana firmasının, onu aktif tutmak için gereken ücretleri ödemeyi bırakmaya karar vermesiyle sona erdi.

Fotoğraf-7: Pierre Meulien.Credit: IMI Joint Undertaking.
Meulien’in grubu, Merck ekibi gibi, bunun yerine DNA aşılarına ve diğer vektör tabanlı sistemlere odaklanmaya başladı. DNA platformu nihayetinde veterinerlik uygulamaları için birkaç lisanslı aşı sağladı (örneğin balık çiftliklerinde enfeksiyonları önlemeye yardımcı olan aşılar gibi). Ve daha geçen ay, Hindistan’da ki araştırmacılar, COVID-19’u önlemeye yardımcı olmak için dünyada ilk insan kullanımı için geliştirilen DNA aşısına acil durum onayı verdi . Ancak tam olarak anlaşılamayan nedenlerden dolayı, geliştirilen bu DNA aşılarısının insanlarda başarıyı bulması oldukça yavaş olmuştur.
Jeffry Ulmer, endüstride ki bu DNA teknolojisi etrafındaki uyumlu çalışmaların, RNA aşıları için de faydaları olduğunu savunuyor. Ulmer “Üretimle ilgili hususlardan ve düzenleyici deneyimden dizi tasarımlarına kadar DNA’dan öğrendiğimiz birçok şey doğrudan RNA’ya uygulanabilir ve aslında yapılan bu çalışmalar RNA’ya yönelik geliştirilen çalışmaların başarısı için temel oluşturmakta” diyor.
Sürekli Mücadele
1990’larda ve 2000’lerin çoğunda, mRNA üzerinde çalışmayı düşünen hemen hemen her aşı şirketi, finansal kaynaklarını başka bir yere aktarmayı seçti. Sektördeki geleneksel görüş, mRNA’nın bozulmaya çok meyilli olduğu ve üretiminin çok pahalı olduğu yönündeydi. 30 yıl önce bir tür ‘kendi kendini çoğaltan’ RNA aşısının araştırılması için kurulan ekibe liderlik yapan Stockholm’deki Karolinska Enstitüsü’nden bir virolog olan Peter Liljeström, konuya yönelik olarak “Sürekli bir mücadeleydi” diyor.
1989’da Austin, Teksas’ta ilk RNA odaklı laboratuvar malzemeleri şirketlerinden biri olan Ambion’u kuran Matt Winkler, “RNA ile çalışmak çok zordu ve eğer geçmişte bana bir hastalıkla mücadele için birisine aşılarla RNA enjekte edeceğimizi söyleseydiniz yüzünüze gülerdim” diyor.
mRNA aşısı fikri, onkoloji alanında; hastalığı önlemekten ziyade terapötik bir ajan olarak daha olumlu bir kabul gördü. Gen terapisti David Curiel’in çalışmasından başlayarak, akademik mecradan birkaç bilim insanı ve yeni kurulan birkaç şirket, mRNA’nın kanserle savaşmak için kullanılıp kullanılamayacağını araştırdı. Fikir: Eğer mRNA, kanser hücreleri tarafından ifade edilen proteinleri baskılayabilirse işte o zaman mRNA’ları vücuda enjekte ederek, bağışıklık sistemini kanserli hücrelere saldırmaları için eğitebiliriz şeklindeydi.
Curiel, şimdi St Louis, Missouri, Washington Üniversitesi Tıp Fakültesi’nde fareler üzerinde yaptığı bazı çalışmalarla başarılı sonuçlar elde etmiş ancak Ambion’a bu fikri ticarileştirme fırsatları hakkında imkan olup olmadığını sorduğunda, firmanın kendisine “Bu teknolojide herhangi bir ekonomik potansiyel görmüyoruz” dendiğini söylüyor.
Başka bir kanser immünologu da benzer ve oldukça çok başarılı bir sonuç elde etti ve bu da 1997’de ilk mRNA terapötik şirketinin kurulmasına yol açtı. Eli Gilboa’nın fikrine göre; bağışıklık hücrelerinin tamamının kandan alınarak tümör proteinlerini kodlayan sentetik mRNA’yı alacak şekilde muamele edilmesi ve muamele görmüş hücrelerin, gizlenen tümörlere saldırmak için bağışıklık sistemini düzenleyebilecekleri vücuda geri enjekte edilmesi şeklindeydi.
Gilboa ve Kuzey Karolina Durham’daki Duke Üniversitesi Tıp Merkezi’ndeki meslektaşları bunu farelerde göstermiştir . 1990’ların sonunda, akademik işbirlikçiler insan denemelerini başlattı ve Gilboa’nın ticari yan kuruluşu Merix Bioscience (daha sonra Argos Therapeutics olarak yeniden adlandırılmış ve şimdi ki adı CoImmune), kısa süre sonra kendi klinik araştırmalarını izledi. Yaklaşım birkaç yıl öncesine kadar umut verici görünüyordu ancak aday aşı son aşamada büyük bir başarısızlıkla sonuçlandı ve sektörde oldukça modası geçmiş olarak görülmektedir.
Ancak Gilboa’nın bu çalışmasının önemli bir sonucu oldu. Bugün var olan en büyük mRNA şirketlerinden ikisi olan Alman CureVac ve BioNTech şirketlerinin kurucularına mRNA üzerinde çalışmaya başlamaları için ilham verdi. CureVac’den Ingmar Hoerr ve Biontech’den Uğur Şahin’in konuya yönelik olarak Nature’a; Gilboa’nın yaptıklarını öğrendikten sonra, aynısını yapmak istediklerini ancak farklı olarak mRNA’yı doğrudan uygulanmayı hedeflediklerini dile getirmiştirler.

Fotoğraf-8: CureVac’ın kurucusu Ingmar Hoerr(sol); kanser immünolojisti ve ilk terapötik firmanın kurucusu Eli Gilboa(sağ). Credit: Sebastian Gollnow/dpa/Alamy; Eli Gilboa
Şuan Florida’daki Miami Miller Üniversitesi Tıp Fakültesi’nde görev yapan Gilboa çalışmalarının, “Kartopu etkisi yarattığını” dile getiriyor.
Harekete Geçme İvmesi
Hoerr başarıya ulaşan ilk kişiydi. Hoerr 2000 yılında Alman Tübingen Üniversitesi’nde iken, doğrudan yapılan mRNA enjeksiyonlarının farelerin bağışıklık sisteminin aktifleşmesini sağladığını rapor etti . Bu keşfi yaptığı yıl CureVac’ı kurdu. Ancak kurduğu şirketle çok az bilim insanı ya da yatırımcı ilgileniyordu. Hoerr’in erken dönemde fareler üzerinde yaptığı bu deneylerin verilerini sunduğu bir konferansta, ilk sırada ayakta duran Nobel ödüllü bir kişi, ‘Bu bize burada söyledikleriniz tamamen şaçmalık, sadece saçmalık’ şeklinde söylemlerde bulunmuş.
Hoerr’in bu fikrini en sonunda bir yerden para akışı gerçekleşti ve birkaç yıl içinde insanlar üzerindeki testler başladı. O sırada şirketin baş bilim sorumlusu Steve Pascolo, çalışmanın ilk insan deneğiydi: Kendisine mRNA enjekte etti ancak bacağında bir dermatoloğun analiz için biyopsi örnekleri aldığı kibrit başı büyüklüğünde beyaz yara izleri hala vardı. Kısa bir süre sonra, cilt kanserli insanlar için tümöre özgü mRNA’yı içeren daha resmi bir deneme başlatıldı.
Şahin ve immünolog eşi Özlem Türeci de 1990’ların sonlarında mRNA’yı incelemeye başladılar, ancak bir şirket kurmak için Hoerr’den daha uzun bir süre beklediler. 2007’de milyarder yatırımcılara ticari bir plan sunmadan önce, Almanya’daki Mainz Johannes Gutenberg Üniversitesi’nde çalışarak patentler, belgeler ve araştırma hibeleri alarak uzun yıllar teknolojiyele çalışmalarını güncel tuttular ve 2007 yılında 150 milyon € kaynak parası alan Şahin “İşe yararsa, çığır açıcı olacak” diyerek çalışmalara başladı.
Fotoğraf-9: mRNA aşı firması BioNTech’in kurucu ortakları Özlem Türeci(sol) ve Uğur Şahin(sağ). Credit: BioNTech SE 2021.
Aynı yıl, RNARx adlı yeni bir mRNA konseptli bir girişim, ABD hükümetinden küçük işletme hibe fonu olarak 97.396 dolarlık mütevazı bir meblağ ile çalışmalara başladı. Şirketin kurucuları, biyokimyager Katalin Karikó ve immünolog Drew Weissman o dönem her ikisi de Philadelphia’daki Pennsylvania Üniversitesi’nde (UPenn) görev yapmaktaydı ve günümüzde oldukça önemli bir bulgu ile deneylerini gerçekleştirmiştirler: Kariko ve Weissman’ın bu çalışmaların anahtar noktası “mRNA kodunun bir kısmının değiştirilmesi” olmuş ve sentetik mRNA’nın hücrenin kalıtsal bağışıklık savunma sistemini geçmesini sağlanmıştı.
Temel Bilgiler
Karikó, mRNA’yı bir ilaç platformuna dönüştürmek amacıyla 90’lı yıllar boyunca laboratuarda bu konu üzerinde çalışmıştı, ancak hibe kuruluşları fon başvurularını uzun bir süre geri çevirilmişti. 1995 yılında, ardı ardına gelen redlerden sonra, kendisine Pensilvanya Üniversitesin’den ayrılması ya da bir rütbe indirgenmesi ve maaş kesintisini kabul etme seçeneği verildi. O kalmayı ve azimli arayışına devam etmeyi seçti, Malone’un geliştirdiği protokollerde iyileştirmeler yaptı ve hücrelerin terapötik açıdan anlamlı büyük ve karmaşık bir protein üretmesini sağladı.
Fotoğraf-10: mRNA üzerinde yapılan kimyasal modifikasyon yapılan RNA’ların immün savunma sisteminin dikkatinden kaçacağını gösteren bilim insanı Katalin Karikó. Credit: Hannah Yoon/ Bloomberg/Getty
1997 yılında, Pensilvanya Üniversitesin’de laboratuvara yeni başlayan Weissman ile çalışmaya başladı. Birlikte HIV/AIDS için mRNA tabanlı bir aşı geliştirmeyi planladılar. Ancak Karikó’nun mRNA’ları, farelere enjekte edildiklerinde büyük inflamatuar reaksiyonlara yol açtı.
Karikó ve Weissman ürettikleri aşının neden işe yaramadığına şu şekilde bir açıklık getirdi: sentetik mRNA, patojen gibi tehlikeli organizmaların sinyallerine ilk müdahalede görev alan bir dizi toll-benzeri reseptörü uyarmaktaydı. Karikó ve Weissman 2005’te, mRNA’nın nükleotidlerinden biri olan üridin üzerindeki kimyasal bağları, pseudouridin adı verilen bir analog oluşturmak için yeniden düzenlemenin, vücudun mRNA’yı düşman olarak tanımlamasını engellediğini keşfetti.

Fotoğraf-11: Katalin Karikó ile modifiye edilen mRNA’ların keşfinde çalışan Drew Weissman. Credit: Penn Medicine
O zamanlar çok az bilim insanı, bu modifiye edilmiş nükleotitlerin terapötik değerini kabul etti. Ancak bilim dünyası çok geçmeden potansiyellerinin farkına vardı ve Eylül 2010’da, o zamanlar Massachusetts’teki Boston Çocuk Hastanesi’nde kök hücre biyoloğu olan Derrick Rossi liderliğindeki bir ekip, modifiye mRNA’ların deri hücrelerini, önce stem hücrelerine ve daha sonra kasılan kas dokusuna dönüştürmek için nasıl kullanılabileceğini keşfetti. Bu bulgular büyük bir patlama yarattı. Rossi, Time dergisinde 2010’un ‘önemli insanlardan’ biri olarak yer aldı ve ardından Cambridge’de Moderna adlı bir start-up kurdu.
Moderna, Pensilvanya Üniversitesi’nin 2006 yılında Karikó ve Weissman’ın buluşu için sunduğu değiştirilmiş mRNA patentlerini lisanslamaya çalıştı ancak bunun için geç kalmıştı çünkü Pensilvanya Üniversitesi, RNARx ile bir lisans anlaşmasına varamadıktan sonra hızlı bir ödemeyi tercih etmiş ve Şubat 2010’da, Madison’daki küçük bir laboratuvar reaktifleri tedarikçisine patent haklarını vermiştir. Şimdi Cellscript olarak adlandırılan şirket, bu lisansı almak için 300.000 dolar gibi bir rakam ödemişken COVID-19 için ilk mRNA aşılarının yaratıcıları olan Moderna ve BioNTech’ten yüz milyonlarca dolar alt lisans ücreti almış ve almaya devam edecek.
Bu arada RNARx, küçük işletme hibe finansmanında 800.000 dolar daha kullanarak ve 2013’te, Karikó’nun BioNTech’e katıldığı sıralarda faaliyetlerini durdurdu.
Psödoüridin Tartışması
Araştırmacılar hala Karikó ve Weissman’ın keşfinin başarılı mRNA aşıları için gerekli olup olmadığı konusunda tartışma halinde. Moderna her zaman değiştirilmiş mRNA’lar( bu ad pormanto bir kelimedir) kullandı. Ama sektördeki bazı şirketler ve araştırmacılar kullanmayı gerek görmemiştir.
Massachusetts, Lexington’daki ilaç firması Shire’ın insan-genetik-terapileri bölümündeki araştırmacılar, değiştirilmemiş mRNA’nın, doğru ‘başlık’ yapıları eklendiğinde ve tüm safsızlıklar çıkarıldığında aynı derecede etkili olan bir ürün verebileceğini düşündüler. Shire’ın araştırmalarına öncülük eden ve Shire’ın daha sonra mRNA çalışmaları ile ilgili tüm belgeleri satacağı Cambridge’deki Translate Bio’da teknolojiyi geliştirmeye devam eden Michael Heartlein, “Tartışmaların açıklaması basit, başarı RNA’nın kalitesine bağlıydı” diyor. (Shire artık Japon firması Takeda’nın bir parçası.)
Translate Bio’nun yapmış olduğu bu mRNA’nın ilgili bağışıklık yanıtlarını tetiklemediğini gösteren bazı insan verileri bulunsa da, bu bulguların klinik olarak kanıtlanması gerekiyor. Ancak Fransız ilaç devi Sanofi, bu teknolojinin vaadine ikna oldu ve Ağustos 2021’de Translate’i 3,2 milyar dolara satın almayı planladığını duyurdu (Heartlein geçen yıl Waltham, Massachusetts’te Maritime Therapeutics adlı başka bir firma kurmak için Translate Bio’dan ayrıldı).
Bu arada CureVac aşılarında mRNA’nın bağışıklık sistemini daha az uyardığı bir stratejiye sahipti: genetik dizisinin değiştirilerek içeriğindeki uridin miktarının azaltılmasıydı. Şirketin geliştirdiği kuduz ve COVID-19 aşılarının ilk denemelerinin her ikisinin de deneme aşamalarını başarılı bir şekilde geçtiği kanıtlanmış ve aslında bu yaklaşım sayesinde yirmi yıldır süren çalışmaların meyveleri yavaş yavaş alınmaya başlanmış gibiydi. Ancak Haziran ayında, yapılan bir denemede elde edilen veriler, CureVac’ın koronavirüs aşı adayının Moderna’nın veya BioNTech’inkinden çok daha az koruyucu özelliğe sahip olduğunu gösterdi.
Bu bilgiler ışığında, bazı mRNA uzmanları; psödoüridinin bu teknolojinin temel bir bileşeni olarak görülmesi gerektiğini, bu nedenle, Karikó ve Weissman’ın keşfinin tanınmayı ve ödülleri hak eden en önemli çalışmalardan birisi olduğunu söylüyorlar. mRNA tabanlı terapötikler üzerinde çalışan Cambridge merkezli bir sentetik biyoloji şirketi olan Strand Therapeutics’in kurucu ortağı ve CEO’su Jake Becraft, “Burada gerçek kazanan, değiştirilmiş RNA’dır” diyor.
Elbette tüm bilim insanları bu konuda hem fikir değil. COVID-19 için mRNA aşısı geliştiren ve klinik testlerde son aşamaya gelmiş Çinli bir şirket olan Suzhou Abogen Biosciences’ın CEO’su Bo Ying, “Bir mRNA aşısının güvenliğini ve etkinliğini etkileyebilecek birçok faktör var ve mRNA’nın kimyasal modifikasyonu bunlardan sadece birisi” diyor. (Şirketin ARCoV olarak bilinen ürününde, değiştirilmemiş mRNA kullanılmaktadır.)
Mükemmel İlerleme
İş bu tarz temel teknolojilere gelince, birçok uzman mRNA aşıları için çok önemli olan başka bir yeniliğin altını çiziyor ancak bu yeniliğin mRNA ile hiçbir ilgisi yok. Bu teknoloji mRNA’yı koruyan ve hücrelere taşıyan lipid nanoparçacıkları veya LNP’ler olarak bilinen küçük yağ kabarcıklarıdır.
Bu teknoloji, Vancouver, Kanada’daki British Columbia Üniversitesi’nde biyokimyager olan Pieter Cullis’in laboratuvarından ve onun kurduğu veya yönettiği birkaç şirketten geliyor. Cullis işe 1990’ların sonunda, geni susturmak için gereken nükleik asit dizilerinin taşıması için LNP’leri üretmekle başladı. Bu tarz bir tedavi, patisiran adlı günümüzde nadir olarak görülen kalıtsal bir hastalık için onaylanmıştır.

Fotoğraf-12: Pieter Cullis.Credit: Paul Joseph for UBC
Bu gen susturma tedavisi klinik deneylerde umut vermeye başladıktan sonra, 2012’de Cullis’in iki şirketi mRNA bazlı ilaçlarda LNP dağıtım sistemi fırsatlarını araştırmak için harekete geçti. Örneğin, Thomas Madden tarafından yönetilen Vancouver’daki Acuitas Therapeutics, Weissman’ın Pensilvanya Üniversitesindeki grubuyla ve birkaç farklı mRNA ortak olarak farklı mRNA-LNP formülasyonlarını test etmek için çalışmalara başladı. Geliştirilen bu LNP sistemilerinden biri artık BioNTech ve CureVac’ın COVID-19 aşılarında kullanılmakta ve aynı şekilde Moderna’nın LNP karışımı da bu ikisinden çok farklı değildir.
Nanopartiküller, dört yağ molekülünün bir karışımına sahiptir: Üçü yapı ve stabiliteye katkıda bulunur; dördüncüsü ise iyonlaşabilen lipid olarak adlandırılır ve LNP’nin başarısının anahtarıdır. Bu madde, Felgner’in geliştirdiği ve Malone’un 1980’lerin sonlarında test ettiği lipozomlara benzer avantajlar sunan, laboratuvar koşulları altında pozitif yüklü moleküldür. Ancak Cullis ve ticari ortakları tarafından geliştirilen iyonlaşabilir lipitler, kan dolaşımı gibi çeşitli fizyolojik koşullar altında nötr bir yüke dönüşür ve bu da vücut üzerinde oluşabilecek toksik etkileri sınırlar.
Ayrıca, Cullis’e bağlı birkaç girişimin eski yöneticisi olan Ian MacLachlan, dört lipidli kokteylin geliştirilen ürünün eczane rafında daha uzun süre saklanmasına ve vücut içindeki dengesini korumasına olanak tanıdığını söylüyor. Cullis “Şu anda sahip olduğumuz farmakolojiyi çalışır kılan tüm kit ve kabine aslında bu kokteyl” diyor.

Fotoğraf-13: Ian MacLachlan (sol) ve Thomas Madden (sağ).Credit: Ian MacLachlan; Acuitas Therapeutics
2000’lerin ortalarında, bu nanoparçacıkları karıştırmanın ve üretmenin yeni bir yolu icat edildi. Bu yöntem; yağları (alkolde çözülmüş) nükleik asitlerle (asidik bir tamponda çözülmüş) birleştiren bir ‘T-bağlayıcı’ aparatı kullanmayı içeriyordu. Bu iki çözeltinin akışları birleştiğinde, bileşenler kendiliğinden yoğun şekilde paketlenmiş LNP’ler oluşturmaktaydı. Bu yöntemin diğer mRNA bazlı ilaçların üretim yollarından daha güvenilir bir teknik olduğu kanıtlanmıştır.
Şimdi San Diego’daki Replicate Bioscience’ın baş proje geliştirme sorumlusu Andrew Geall, “Tüm doğru parçalar bir araya geldiğinde sanki kutsal bir duman oluşmuş gibiydi, sonunda ölçekleyebileceğimiz bir sürecimiz olmuştu” diyor. Geall , 2012’de Novartis’in Cambridge’deki ABD merkezinde LNP’leri bir RNA aşısı ile birleştiren ilk ekibi yönetmiştir. Her mRNA şirketi artık bu LNP dağıtım platformunun ve üretim sisteminin bazı varyasyonlarını kullanıyor ancak anlaşmazlıklara rağmen ilgili patentlerin sahibi olan kişi yasal olarak tabi olmaya devam ediyor. Örneğin, Moderna’nın COVID-19 aşısında bulunan LNP teknolojisinin haklarına kimin sahip olduğu konusunda Cullis’e bağlı bir işletme olan Vancouver’daki Arbutus Biopharma ile hukuki bir savaş söz konusu.
Yeni Bir Endüstri Doğuyor
2000’lerin sonunda, birkaç büyük ilaç şirketi mRNA alanına girmiştir. Örneğin 2008’de hem Novartis hem de Shire, mRNA araştırma birimleri kurdu( ilki Geall liderliğinde aşılara, ikincisi Heartlein liderliğinde terapötiklere odaklanmıştı). BioNTech o yıl piyasaya çıktı ve diğer start-up’lar da kısa süre sonra ABD The Defense Advanced Research Projects Agency’nin RNA aşılarını ve ilaçlarını araştırmak için endüstri araştırmacılarına fon sağlamaya başlama kararıyla desteklendi. Moderna, bu işi temel alan şirketlerden biriydi ve vücuttaki hücreleri kendi ilaçlarını üretebilecek şekilde ayarlamak için mRNA’yı kullanılabileceği, böylece eksik veya kusurlu proteinlerin neden olduğu hastalıkları düzeltmenin mümkün olabileceği vaatleriyle 2015 yılına kadar 1 milyar dolardan fazla para topladı. Bu plan başarısız olduğunda, CEO’su Stéphane Bancel liderliğindeki Moderna, daha az riskli ve iddialı bir hedefe öncelik vermeyi seçti: Aşı üretmek.

Fotoğraf-14: Moderna’dan Derrick Rossi (sol) ve Stéphane Bancel (sağ).Credit: Derrick Rossi; Adam Glanzman/Bloomberg/Getty
Bu alınana karar, başlangıçta birçok yatırımcıyı ve izleyiciyi hayal kırıklığına uğrattı, çünkü bir aşı platformu daha az dönüştürücü ve kazançlı görünüyordu. 2020’nin başında Moderna, bulaşıcı hastalıklar için dokuz mRNA aşısı adayını test için insanlara sundu, fakat aşıların hiçbiri tam anlamıyla başarılı olmadı ve sadece bir tanesi daha büyük aşamalı bir denemeye geçebildi.
Ancak COVID-19 vurduğunda Moderna, virüsün genom dizisinin çevrimiçi olarak kullanıma sunulmasından sonraki günler içinde bir prototip aşı oluşturarak hedeften hızlı bir şekilde uzaklaştı. Şirket daha sonra ABD Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü (NIAID) ile fareler üzerinde yaptıkları deneyler ve insan denemelerini başlatmak için on haftadan kısa bir süre içinde işbirliği yaptı.
BioNTech de her şeyi kapsayan bir yaklaşım benimsedi. Mart 2020’de New York merkezli ilaç şirketi Pfizer ile ortaklık kurdu ve ardından klinik denemelerde rekor bir hızla ilerledi, insanlar üzerinde yapılan ilk testten tam sekiz aydan kısa bir süre sonra acil durum onayı alarak kullanım başlandı.
İzin verilen her iki aşıda da LNP’lerden formüle edilmiş modifiye mRNA kullanılmaktadır. Her ikisi de immün sistemi uygun bir şekilde indükleyebilen, SARS-CoV-2 spike proteininin bir formunu kodlayan diziler içerir. Birçok uzman, NIAID aşı uzmanı Barney Graham ve Austin’deki Texas Üniversitesi’nden yapısal biyolog Jason McLellan ve Scripps’ten Andrew Ward tarafından tasarlanan bu protein ayarının, koronavirüs aşılarına özgü olsa da ödüle değer bir katkı olduğunu söylüyor.
mRNA keşifleri için credit tartışmalarındaki öfkenin bir kısmı, kimin karlı patentlere sahip olduğuyla ilgili ancak temel fikri mülkiyetin çoğu, 1989’da Felgner, Malone ve Vical’daki meslektaşları (ve 1990’da Liljeström) tarafından yapılan çalışmalara dayanmaktadır. Bu bahsi geçen bulguların(Felgner, Malone ve Vical’daki meslektaşlarına ait) yayın tarihinden itibaren yalnızca 17 yıllık bir süresi vardı ve bu nedenle artık kamu malı.
Cellscript’e lisanslanan ve 2006’da dosyalanan Karikó–Weissman patentleri bile önümüzdeki beş yıl içinde sona erecek. Endüstri uzmanları bunun, mRNA’ların lipit nanopartiküller içinde teslim edilmesine ilişkin geniş iddiaları patentlemenin yakında çok zor olacağı anlamına geldiğini söylüyor, ancak şirketler makul bir şekilde belirli mRNA dizilerini (örneğin bir spike proteininin formunun) veya tescilli lipit formülasyonlarını patentleyebilirler.
Firmalar çabalıyor. mRNA aşı alanında oldukça dominant bir oyuncu olan Moderna, geçen yıl influenza, sitomegalovirüs ve bir çok enfeksiyonel hastalık için gizlenmiş proteinlerin üretiminde rol alan iki mRNA’nın geniş kullanımını kapsayan iki patent aldı. Ancak birçok endüstri uzmanı, bunların zor olacağını düşündüklerini belirtmekte .
Kanada, Calgary’deki bir mRNA aşısı şirketi olan Providence Therapeutics’in baş sorumlusu Eric Marcusson, “Patentlenebilir ve kesinlikle uygulanamaz pek bir şey olduğunu düşünmüyoruz” diyor.
Ödül Tartışması
Ödülleri kimin hak ettiğine gelince, konuşmalarda en çok öne çıkan isimler Karikó ve Weissman. İkisi , Çığır Açan Ödüllerden biri (3 milyon dolar, bilimdeki en kazançlı ödül) ve İspanya’nın prestijli Teknik ve Bilimsel Araştırma Asturias Prensesi Ödülü de dahil olmak üzere şimdiden birçok ödül kazanmış durumda. Asturias ödülünde ayrıca Felgner, Şahin, Türeci ve Rossi ile İngiltere Oxford Üniversitesi tarafından geliştirilen COVID-19 aşısının arkasındaki aşı uzmanı Sarah Gilbert ve bunun yerine viral bir vektör kullanan ilaç firması AstraZeneca vardı. (Cullis’in son zamanlardaki tek ödülü, zamanla salınan ilaçlar üzerinde çalışan profesyonel bir bilim insanı organizasyonu olan Controlled Release Society’den 5.000 dolarlık bir kurucu ödülü.)
Bazıları ayrıca, Karikó’nun laboratuvardaki keşifleri için olduğu kadar genel olarak mRNA araştırma topluluğuna yaptığı katkılardan dolayı da birçok ödülün sahibi olduğunu savunuyor. British Columbia Üniversitesi’nde RNA biyomühendisi olan Anna Blakney, “O sadece inanılmaz bir bilim insanı değil, bilim sahasında da inanılmaz bir güç” diyor.
Malone da dahil olmak üzere bazıları mRNA’nın gelişimine dahil olsa da, kimisi daha fazla tanınmayı hak ettiklerini düşünürken, kimisi ilgiyiıpaylaşmaya daha istekli. Cullis, “Gerçekten kredi talep edemezsiniz. Örneğin, lipid dağıtım sistemi söz konusu olduğunda, bu LNP sistemlerini gerçekten hazır hale getirmek için birlikte çalışan yüzlerce, muhtemelen binlerce insandan bahsediyoruz” diyor
Karikó, “Ben de dahil herkes adım adım bir şeyler ekledi” diyor.
Geriye dönüp bakıldığında, birçok bilim insanı mRNA aşılarının insanlık için bir fark yaratmasından ve bu yolda değerli bir katkı yapmış olabileceklerinden memnun olduklarını söylüyor. Felgner, “Bunu görmek benim için heyecan verici. O zamanlar hayalini kurduğumuz ve bir gün olacağını düşündüğümüz her şey şimdi oluyor” diyor.
22 Ekim 2021 Tarihli Düzeltme: Kalıtsal bağışıklık sistemini iyileştirmek için spike dizisinde yapılan bir değişikliğin daha önceki bir versiyonu, koronavirüs aşılarına özel anlamda bir katkı olduğu ima edilmiştir. Aslında, bu tür proteinler üzerinde yapılan ince ayarlar/değişiklikler birçok viral aşıya uygulanabilir. Ayrıca haber, erken patent başvurularında mRNA aşı deneylerinden bahsetmeyi içerecek şekilde güncellenmiştir.
Kaynak : nature.com






