Hidrazin – N2H4
Hidrazin, kimyasal formülü N2H4 (H2NNH2 olarak da bilinir) olan inorganik bir bileşiktir. Amonyak benzeri bir kokuya sahip, renksiz yanıcı bir sıvıdır. Hidrazin son derece toksiktir ve tehlikeli şekilde. 2000 yılı itibariyle, yılda yaklaşık 120.000 ton hidrazin hidrat (ağırlık olarak suda% 64’lük bir hidrazin çözeltisine karşılık gelir) üretilmiştir. Hidrazin, esasen polimer köpüklerin hazırlanmasında bir köpürme maddesi olarak kullanılır bununa birliktr bazı önemli uygulamaları da; polimerizasyon katalizörlerinde ve ilaçlarda yaygın olarak kullanılmasıdır. Ayrıca, hidrazin çeşitli roket yakıtlarında ve hava yastıklarında kullanılan gaz öncüllerini hazırlamak için kullanılır. En bilindik şekilde kullanım uygulamalarından biri de; hem nükleer hem de konvansiyonel elektrik santrali buhar çevrimlerinde, korozyonu azaltmak için çözünmüş oksijen konsantrasyonlarını kontrol etmek için bir oksijen süpürücüsü olarak kullanılmasıdır. Susuz hidrazin, hidroflorik asite benzer şekilde cam için aşındırıcıdır.
Hidrazin ürünleri temel olarak oksijen temizleyicileri, kimyasal patlayıcı ara ürünler, monopropellantlar ve çift taraflı roket yakıcı maddeler de kullanılan bir kimyasaldır. Hidrazin bu formlarda güvenli ve başarılı bir kullanım hikâyesine sahip olmakla birlikte, toksik özellikleri nedeniyle son zamanlarda oldukça dikkat çekmiştir.
Hidrazine ve kullanımına ilişkin yönetmeliklerde toksikolojik bilgiler son zamanlarda yeeniden gözden geçirilmiştir. Hidrazinin doğası, personel maruziyeti, vücuda nasıl absorbe edilebileceği ve maruz kalmanın nelerin etkilenebileceği konuları yeniden görüşülmüştür. Bu görüşmeler neticesinde, çalışanların hidrazine maruz kalmaları durumunda zorunlu koruyucu ekipman kullanımı ve uygun taşıma prosedürleri ile desteklenmiş, basit ve etkili mühendislik kontrolleri ile nasıl asgariye indirilebileceği konularına odaklanılmıştır.
Hidrazinin ilk İkinci Dünya Savaşı sırasında ME-163 Alman savaş uçağında bir roket yakıtı olarak kullanıldı. Günümüzde oksitleyici yakıtlar arasında susuz hidrazin (AH), monometil hidrazin (MMH) ve simetrik olmayan dimetil hidrazin (UDMH) ve % 70 sulu hidrazin (H-70) ürünleri bulunmaktadır. Hidrazin yakıtları tarihsel olarak, nitrojen tetroksitli iki bileşenli ve bir monopropelant olarak üretilmiştir. Bir monopropelant olarak hidrazinin kullanımı, uydular ve uzay aracı için yörünge kontrolü ve tutum sağlamak için hidrazinin uygun bir katalizör varlığın da parçalanarak gaz halindeki ürünler ortaya çıkarması ile olur. Hidrazin ayrıca bir korozyon önleyici / oksijen süpürücü olarak uygulanmak üzere sulu solüsyonlar halinde üretilir ve satılır. Bununla birlikte tarımsal ürünler, kimyasal köpükleştirici maddeler ve patlayıcı ara ürünlerin kimyasal bir yapı taşı olarak yaygın şekilde kullanılmaktadır. Basit perklorat, nitrat ve azid tuzlarını içeren bir dizi hidrazin türevi patlayıcı maddedir.5-aminotetrazol, guanylazid ve tetrasen de dahil olmak üzere hidrazin türevi aminoguanidin türevleri, cephane primer bileşeni olarak kullanılan tetrasenli patlayıcılardır. Hidrazin, şimdiki ve ön görülen kullanımları yüksek derecede reaktiviteye dayanması sebebiyle önemli bir endüstriyel kimyasaldır. Bununla birlikte kararsız ve tehlikeli kimyasal olmanın getirdiği itibarı yadsınamaz şekilde ortadadır.
Hidrazinin taşınmasıyla ilgili tehlikelerin niteliğine ilişkin yanlış anlaşma, bileşik yalıtılmadan önce başlamış ve yıllarca devam etmiştir. İlk kez hidrazin çözeltisi hazırlayan Curtius,”serbest bazın çok fazla kararsız olduğunu bu durumda serbest halde bulunamayacağı” görüşünü dile getirdi. Curtius’un bu tahmininin, daha sonra, susuz serbest bazı izole eden Labry de Bruyn tarafından yanlış olduğu kanıtlandı ve Labry de Bruyn çok kararlı bir bileşik ve hidrojen peroksitin aksine patlayıcı olmadığını savundu. Hidrazini ayrışmadan 300 oC’nin üzerinde ısıtılabildi. Bu gözlemine ve aksine diğer deneysel kanıtlara rağmen, içsel istikrarsızlık fikri devam ediyordu. Amerikan Hükümei Sanayi Hijyenistler Konferansı (ACGIH) ve Uluslararası Kanser Araştırmaları Ajansı, hidrazini şüpheli kanserojeni olarak belirtti. Hidrazin ürünleri gerçekten tehlikeli ürünlerdir, fakat aynı şekilde, endüstride kullanılan bir çok kimyasalı için de bu durum söz konusudur. Endüstiride hidrazinin özelliklerinin farkında olarak gerçekleri yanlış anlaşılmalardan ayırabilir ve hidrazinle başa çıkmanın en iyi yolunu bulunmalıdır, daha sonra güvenli bir şekilde kullanabilmelidir.
1 -) Hidrazinin Özellikleri
Bu konu başlığı altında hidrazinin güvenli kullanımı ile ilgili mevcut bilgilerin bazılarını özetlemek için bir giriş yapılmaktadır. Bu amaçla hidrazinin susuz ve sulu çözelti ürünleri ile ilgili bilgileri kapsanacaktır. Daha ayrıntılı bilgi verebilmek amacıyla bir dizi mükemmel referansta ele alınmıştır.
1.1 Fiziksel
Susuz hidrazin (N2H4), atmosferden CO2 veya oksijen emecek kadar oldukça polar ve higroskopik bir sıvıdır. 2 0C’de erir ve 113,5 0C’de (760 mm Hg) kaynar. Katı haldeki yoğunluğu (1.146/-50C) sıvı haldeki yoğunluğundan (1.024/20C) daha yüksek olduğu için donma koşullarında bulunduğu kapları parçalama tehlikesi yoktur.
Susuz hidrazin için buhar basınçları aşağıdaki ampirik denklem ile temsil edilmektedir:
Log10P(mm Hg) =7.80687 -1680.745/(t + 227.74)
Atmosferik kaynama noktasının üstünde termal ayrışma nedeniyle veriler daha güvenilirdir. Hidrazin ve su, % 58.5 mol N2H4 içeren 120.3 °C’de (760 mm Hg) kaynayan bir azeotropik karışım oluşturmaktadır. N2H4.H20 sistemindeki donma noktası (Tablo I) verileri, bileşik N2H4.H20’nin -51.7 °C’de eriyen kararlı bir katı faz olduğunu göstermektedir. Ötektik %29.5 mol (-88 C m.p.) ve %56 mol (-53.5 °C m.p.) arasında bulunur.
1.2 Kimyasal
Kimyasal açıdan bakıldığında, hidrazin çok güçlü bir indirgeyici madde ve hafif alkalin bir baz olarak sınıflandırılır. Konsantre, sıcaklık ve katalitik koşullara bağlı olarak reaksiyon hızıyla çoğu oksitleyici ajan ve mineral asit ile kolayca ve ekzotermik reaksiyona girer.
Oksitleyici maddelerin örnekleri sadece elektronegatif elementleri ve oldukça oksitlenmiş bileşikleri değil aynı zamanda bazı metallerin ve hatta bazı metal iyonlarının daha düşük oksitlerini içerir. Hidrazin sıvı veya buhar, konsantre veya seyreltik, serbest veya kombine edilebilir. Başlıca ürünler genellikle N2 ve H2O dur. Ancak bazı durumlarda önemli miktarda NH3 üretilmektedir.
Birçok kimyasalda olduğu gibi, hidrazin ürünleri ve hidrazin sıvı yakıtları ile uğraşırken bazı önlemler alınmalıdır. Hidroklorik, sülfürik ve nitrik gibi asitler ve hipokloritler, hidrojen peroksit, permanganatlar, kromatlar vb. oksitleyiciler hidrazinin işlendiği veya saklandığı alanlarda bulundurulmamalıdır.
Hidrazinin oksitleyiciler veya asitlerle reaksiyon yoğunluğunun reaktanların konsantrasyonuna bağlı olduğunu bilmek önemlidir. Hidrazin konsantrasyonu ne kadar düşük olursa reaksiyon hafifleşir.
1.3 Yanabilirlik
Sıvı susuz hidrazin çok kararlı ve patlayıcı değildir. Ayrışma katalizörleri yokluğunda, 500oF’nin üzerinde ısıtıldığında çok az bozunur.
Ancak hidrazin buharı tehlike oluşturmaktadır. Havadaki hidrazin buharının karışımları hacimce % 4.7 ve %100 sınırları arasında hidrazin yanıcıdır. Hidrazin buharının yanıcılığı çeşitli seyrelticilerden herhangi birinin kullanılmasıyla azaltılır. Her an kullanılabilme için hazır olma ve maliyet nedeniyle azot gazı genellikle tercih edilen seyrekticilerdendir. Bir hidrazin-azot-hava karışımının düşük patlama limiti % 4.7 hava ve % 38 azot vardığında 228oF ila 234 oF arasındadır.
Diğer çoğu kimyasalın aksine hidrazinin patlayıcı konsantrasyon aralığı için herhangi bir üst sınırı yoktur. Soğuk sıvı hidrazinin yakılması zordur. Ateşleme yalnızca sıcaklık 126°F’ın üstünde yükseldiğinde gerçekleşir. Havada rahatça yanarken hidrazin benzine çok benzer şekilde davranır. Bununla birlikte, yüksek sıcaklıklarda şiddetli yanar.
% 40’ın altındaki herhangi bir konsantrasyonda hidrazin su solüsyonları tutuşturulamaz. % 50’lik bir solüsyon yalnızca kaynama noktasının yakınında yanacaktır konsantrasyonun artmasıyla yanma sıcaklığı susuz ürün için yaklaşık 126 ° F’ye düşer (Bakınız Tablo I).Su, hidrazinin yanmasın ile savaşmanın en iyi yoludur, çünkü hidrazin yanıcı sınırının altında soğutulması ve seyreltilmesi gibi birleşik etkiden etkilenerek sönecektir.
1.4 Kararlılık
Normal şartlar altında susuz hidrazin ve sulu hidrazin solüsyonları kararlıdır elektrik darbesine ve sürtünmeye duyarsızdır. Patlayıcı bir tehlike oluşturmaz ve uzun süre saklama testleri ürünlerinde ihmal edilebilir derecede bozunma göstermiştir. Hidrazinin bozunması yüksek sıcaklıklara, katalitik yüzeylerin veya iyon safsızlıklarının varlığına bağlıdır.
Sıcaklık arttıkça hidrazin yavaş yavaş parçalanarak azot ve amonyak üretir. 500°F’a kadar olan sıcaklıklarda yapılan çalışmalarda parçalanmanın çoğunun buhar fazında gerçekleştiğini ve ayrışma oranının sıcaklığın direkt bir fonksiyonu olduğunu göstermiştir. Katalitik faktörlerin yokluğunda, 500o F’de dahi hızlı bir bozunum gözlemlenmemiştir.
Bazı metalik iyonlar ve metal oksit yüzeyleri, hidrazin ayrışması üzerine belirgin bir katalitik etki gösterirler. Laboratuvar çalışmaları, kromik, ferrik ve bakır iyonların, bir azot örtüsü altında ve geri akışın sağlandığı koşullarında hidrazin ayrışmasını katalize ettiğini göstermiştir. Ortam koşullarında çözünmüş iyonların fark edilebilir bir etkisi yoktur. Molibden, demir, Raney nikeli, pas, bakır oksit veya kobaltın ince bölünmüş halde hidrazin ile temas ettiğinde bir yüzey alanı katalitik etkisi ortaya çıkar. Demir pasındaki bir hidrazin filmi yetersiz havalandırma ve serin olmayan koşullar altında alevler içine patlar.
Asbest, genişletilmiş vermikülit, talaş, paçavra, kağıt ve bazı metal tozuun hidrazin ile nemlendirildiğinde ve oda sıcaklığında atmosfere maruz bırakıldığında hidrazinin tutuştuğu gözlemlendi. Bu durum kuruyan yağların spontan ateşlemesine benzer şekilde, sıcaklığın yayılmasını önleyen koşullar altında yavaş oksidasyonla başlayacak ve ateşleme sıcaklığına ulaşana kadar sıcaklığın artmasıyla daha hızlı ilerleyecektir. Gözenekli katı maddenin etkisi ya katalitik olabilir ya da sadece ısı dağılımına karşı bir engel oluşturabilir.
1.5 Sağlık tehlikeleri
Susuz hidrazin ve sulu hidrazin solüsyonlarının güvenli ve başarılı bir kullanım öyküsü olsa da, hidrazinin toksik özelliklerinden dolayı son zamanlarda çok dikkat çekmiştir. Amerikan Hükümet Sınai Hijyenistler Konferansı (ACGIH) ve Uluslararası Kanser Araştırmaları Ajansı, hidrazini şüpheli kanserojen olarak belirtmiştir. Kimyasal sanayi endüstrisinin çoğunda hidrızin işlenmesine ramen hidrazin çözeltileri gerçekten tehlikeli ürünlerdir.
İş güvenliği ve sağlığı ile ilgili sorunlar sadece bir kimyasalın toksisitesi olmamalı, doğru kullanım yöntemlerini seçme ve benimseme meselesi olmalıdırlar. Zorunlu koruyucu ekipman kullanımı, kimyasalın toksik ve fiziksel/kimyasal özelliklerine göre ihtiyatlı ve uygundur. Düzgün bir şekilde ele alınmadığı sürece hiçbir kimyasal tamamen güvenli değildir. Çalışanların maruz kalabilecekleri tehlike ilgili olarak eğitimi ve kullanılacak güvenlik prosedürlerini bilmeleri tehlike potansiyelini en aza indirgemenin en önemli unsurudur.
Personelin hidrazin’e tehlikeli olarak maruz kalması yalnızca önlem-nememiş kazalar neticesinde ortaya çıkmalıdır, çünkü uygun taşıma ve saklama için belirlenen önlemlerin alınması kaza olmadığı normal koşullar altında çalışanları koruyacaktır.
İki maruz kalma türü şunlardır:
1) Büyük bir dökülme, kamyon kazası veya tank çatlağından kaynaklanan akut, kısa süreli, yüksek dozajlı maruz kalma
2) Kronik, uzun süreli, düşük dozajlı maruz kalma.
Doğrudan temas halinde hidrazin cildi, gözleri yakabilir mukoza zarlarını oldukça rahatsız eder. Sağlık tehlikeleri hakkında en güncel ve eksiksiz bilgi için OSHA Tehlike İletişimi standardının gerektirdiği şekilde Malzeme Güvenlik Bilgi Formu ve etiketi ürüne danışılmalıdır.
Hidrazin, akut veya kronik maruz kalma yoluyla toksik miktarlarda vücuda absorplanabilmesine rağmen, çalışanların maruz kaldığı hidrazin, zorunlu koruyucu ekipman kullanımı ve uygun taşıma prosedürleri ile takviye edilmiş basit ve etkili mühendislik kontrolleri ile minimize edilebilir.
Son olarak, havadaki hidrazin konsantrasyonlarının kabul edilebilir seviyelerde veya altında olması için işyeri ortamının iyi havalandırılması son derece önemlidir.Yeterli havalandırma sağlanamıyorsa, kapalı bir taşıma sistemi kullanmak gibi solumaya karşı koruma sağlamak için daha fazla koruyucu ekipman kullanılmalıdır.
1.6 Maruz kalma sınırları
Şu anda kullanımda birkaç hidrazin maruz kalma sınırı bulunmaktadır; bunlardan 1 ppm OSHA limiti gerekli bir standarttır. NIOSH (Ulusal İş Güvenliği ve Sağlığı Enstitüsü) veya ACGIH (Devlet Endüstriyel Hijyenistlerin Amerikan Konferansı) gibi yayımlananlar ve diğerleri yalnızca yönergelerdir. OSHA Standardı, ACGIH 1968 değerlerinden geliştirilmiştir. Tablo III, bu maruz kalma sınırlarını göstermektedir. 0.1 ppm’lik ACGIH tavsiyesi 1985-1986 yılları için olup OSHA standardının kuruluşundan bu yana toplanan toksikoloji bilgilerine dayanmaktadır.
Tablo1
|
HİDRAZİNİN FİZİKSEL ÖZELLİKLERİ |
||||||
| Çözelti Mukavemeti | ||||||
| 35% | 64% | 70% | AH | MMH | UDMH | |
| Yoğunluk gm/ml | 1,0207 | 1,032 | 1,003 | 1,004 | 0,874 | 0,784 |
| Donma noktası °C | -65 | -52 | -56 | 2 | -52 | -57 |
| Kaynama boktası °C 760 mmhg(°F) |
109 | 120.1 (248,2) |
120 (248) |
113.5 (236,3) |
87.5 (198,5) |
63 (146) |
| Parlama Noktası (°F)(coc) | – | 161 | 150 | 125 | 70 | 5 |
Tablo2
| GEÇERLİ MARUZ KALMA LİMİTLERİ | ||||
| Hidrazin | MMH | UDMH | ||
| OSHA | Geçerli Standart | 1 ppm | .2 ppm | .5 ppm |
| NIOSH | Önerilen | 0.03 ppm | 0.04 ppm | 0.06ppm |
| ACGIH | Önerilen | 0.1 ppm | .2 ppm | 05 ppm |
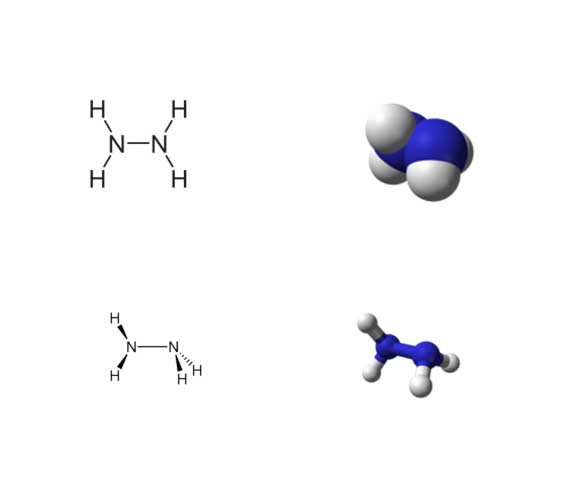
2 -) Moleküler yapı
Her bir H2N-N altbirimi piramit şeklidir. N-N tekli bağ mesafesi 1.45 Â (145 pm) ve molekül bir gauche konformasyonunu benimser. Dönel bariyer etanın iki katıdır. Bu yapısal özellikler “eğri” bir antiklinal konformasyonu benimseyen gaz halindeki hidrojen peroksitinkine benzemekte ve aynı zamanda güçlü bir dönme bariyeri eğilimindedir.
3 -) Sentez ve üretim
Kilit adım azot-azot tekli bağın oluşturulmasıdır, bunu sağlayabilmek adına yıllar boyunca farklı yollar geliştirilmiştir. Olin Raschig sürecinde, klor bazlı oksidanlar keton bulunmadan amonyağın oksitlenmesi ile oluşur. Peroksit işleminde, hidrojen peroksit keton varlığında amonyağın oksitlenmesi ile elde edilir.
3.1 Hipokloritten kloroamin ile amonyak oksidasyonu
Hidrazin, Olin Raschig sürecinde, sodyum hipokloritten (birçok ağartıcıda aktif madde) ve amonyaktan üretilir; 1907’de uygulamaya alınmış bir prosestir. Bu yöntem, yan ürün olarak hidrojen klorürün oluştur, azot-azot tekli bağ oluşturmak için kloramin ile amonyak reaksiyona girer.
NH2CI + NH3 → H2N-NH2 + HC1
3.2 Üre’nin hipoklorit ile oksidasyonu
Raschig işleminde amonyak yerine üre de oksitlenebilir. Yine sodyum hipoklorit oksidan görevi görür. Net reaksiyon şu şekildedir.
(H2N)2C = O + NaOCl + 2NaOH → N2H4 + H20 + NaCl + Na2C03
Bu süreç Asya’ da ağırlıklı olarak uygulanır ve reaksiyon sonucunda hidrazin ile birlikte önemli yan ürünler üretilir.
3.3 Aseton varlığında amonyak üzerinde hipokloritten kloroamin ile oksidasyon
Bayer Ketazine Prosesi peroksit sürecinin öncüsüdür. Hidrojen peroksit yerine oksidan olarak sodyum hipoklorit kullanır. Tüm hipoklorit esaslı reaksiyonlarda olduğu gibi bu yöntemin olumsuz yanı her bir hidrazin eşdeğeri için bir tuz eşdeğeri üretmesindir.
3.4 Oksaziridin ile peroksitten amonyak oksidasyonu
Hidrazin, peroksit işleminde amonyak ve hidrojen peroksitten sentezlenebilir (bazen Pechiney-Ugine-Kuhlmann süreci, Atofina-PCUK döngüsü veya ketazin süreci olarak adlandırılır). Net reaksiyon aşağıdaki gibidir:
2 NH3 + H2O2 → H2N-NH2 + 2 H2O
Bu yöntemde hidrazin birkaç adımda amonyak, hidrojen peroksit ve aseton veya metiletil keton gibi bir ketondan üretilir. Keton ve amonyak önce imin vermek üzere yoğunlaşır, hidrojen peroksit ile oksaziridin, karbon, oksijen ve azot içeren üçlü bir halka oksitlenir. Daha sonra azot-azot tekli bağ oluşur, amanyok oksaziridin ile realsiyona girerek ederek hidrazon oluşturur. Bu hidrazon, bir eşdeğer keton ile yoğunlaşır; Elde edilen azin hidrolize edilerek hidrazin elde edilir ve keton rejenere olur. Olin Raschig Sürecinin aksine, bu yaklaşım da yan ürün olarak bir tuz üretimi olmaz.
4 -) Uygulamaları
4.1 Ana kullanımlar
Hidrazinin çoğunlukla patlama maddelerinin öncüsü olarak kullanılır. Spesifik bileşikler arasında azodikarbonamid ve azobisizobutironitril bulunur ve bu da öncünün gramı başına 100-200 mL gazı verir. İlgili bir uygulamada, sodyum azid, hava torbaları içindeki gaz oluşturucu madde, sodyum nitrit ile reaksiyona sokularak hidrazin’den üretilir. Hidrazin ayrıca, yolcu araçlarında bir yakıt olarak ve büyük endüstriyel kazanlarda kullanılan suyun çözünmüş oksijen konsantrasyonunu düşürülmesi ve kontrol edilmesinde kullanılır. Örneğin F-16 savaş uçaklarında ,uçağın acil durum güç ünitesini beslemek için hidrazin kullanılmaktadır.
4.2 Pestisitler ve farmasötikler için öncü malzeme olarak kullanımı
Hidrazin, birçok ilaç ve zirai ilaç öncüsüdür. Genellikle bu uygulamalar, hidrazinin, pirazoller ve piridazinler gibi heterosiklik halkalara dönüştürülmesini içerir. Ticarileştirilmiş biyoaktif hidrazin türevlerinin örnekleri arasında sefazolin, rizatriptan, anastrozol, flukonazol, metazaklor, metamitron, metribuzin, paklobutrazol, diklobutrazol, propikonazol ve triadimefon bulunmaktadır.
4.3 Roket yakıtı
Hidrazin, İkinci Dünya Savaşı sırasında roket yakıt karışımlarının bir bileşeni olarak ilk kez kullanılmıştır. Almanlar tarafından% 57 metanol (Alman M-Stoff) ve % 13 su ile ağırlıkça% 30 karışım C-Stoff olarak adlandırıldı. Karışım Messerschmitt Me 163B roketle çalışan savaş uçağını çalıştırmak için kullanıldı. Hidrazin ayrıca Alman yüksek test peroksit T-Stoff oksitleyici ile yakıt olarak kullanılmıştır. Karıştırılmamış olan hidrazin, Almanlar tarafından B-Stoff olarak adlandırıldı ve daha sonra V-2 füzesi için metanol / su yakıt için de kullanıldı.
Hidrazin, uzay aracının manevra iticileri için düşük güçlü monopropellant olarak ve Space Shuttle’ın yardımcı güç ünitelerine (APU’lar) güç sağlamak için kullanılır. Buna ek olarak, monopropelalı hidrazin yakıtlı roket motorları genellikle uzay aracının terminal inişinde kullanılır. Bu tür motorlar, 1970’lerde Viking programının iniş takımlarının yanı sıra sırasıyla Mayıs 2008 ve Ağustos 2012’de Mars’ta çıkan Phoenix lander ve Curiosity rover’de kullanıldı.
Tüm hidrazin monopropellant motorlarında, hidrazin yüksek alaşımlı alümina (alüminyum oksit) ile desteklenen iridyum metali gibi veya karbon nanofiberleri veya son zamanlarda alümina üzerinde molibden nitrid katalizörlerinin içinden geçerek aşağıdaki tepkimelere göre amonyak, azot gazı ve hidrojen gazı olarak ayrışmasına neden olur:
- 3 N2H4→ 4 NH3 + N2
- N2H4→ N2 + 2 H2
- 4 NH3+ N2H4 → 3 N2 + 8 H2
1 ve 2 reaksiyonlar son derece ekzotermiktir (katalizör odası milisaniyelik bir süre içerisinde 800 °C’ye erişebilir ve yaklaşık 220 saniye de küçük bir hacimdeki sıvıdan büyük miktarda sıcak gaz üreterek hidrazin, vakumla spesifik bir uyarı etkisi ile oldukça verimli bir itici yakıtelde edilmiş olur. Reaksiyon 3, endotermiktir ve böylece ürünlerin sıcaklığını düşürür, ancak aynı zamanda çok sayıda molekül üretir. Katalizör yapısı, Reaksiyon 3’te ayrışan NH3 oranını etkiler; Roket yakıtları için daha yüksek bir sıcaklık istenirken, reaksiyonların daha büyük miktarlarda gaz üretmesi amaçlandığında daha fazla molekül arzu edilir.
Roket yakıtı olarak kullanılan hidrazinin diğer varyantları monometilhidrazin, (CH3)NH(NH2) (MMH olarak da bilinir) ve simetrik olmayan dimetilhidrazindir (CH3)2N(NH2) (aynı zamanda UDMH olarak da bilinir).
Bu türevler iki bileşenli roket yakıtlarında, çoğunlukla dinitrojen tetroksit N2O4 ile birlikte kullanılır. Bu reaksiyonlar son derece ekzotermiktir ve yanma da hiperglikadır (harici bir ateşleme olmadan yanmaya başlar). Havacılık endüstrisindeki diğer oldukça toksik maddelerle birlikte hidrazinin yerini tutacak farklı malzemeler için devam eden araştırmalar vardır. Umut verici alternatifler arasında hidroksilamonyum nitrat, 2-Dimetilaminoetilazid (DMAZ) ve enerjik iyonik sıvılar yer alır.
4.4 Yakıt Pilleri
İtalyan katalizör üreticisi Acta, yakıt hücrelerinde hidrojene alternatif olarak hidrazin kullanımını önermiştir. Hidrazin’in en büyük yararı, pahalı platin katalizörleri kullanmak zorunda kalmadan benzeri bir hidrojen hücresinden 200 mW / cm2‘den fazla üretebilmesidir. Yakıt oda sıcaklığında sıvı olduğundan, hidrojenden daha kolay ele alınabilir ve depolanabilir. Hidrazin, çift bağlı karbon-oksijen karbonil dolu bir depoda depolanarak, yakıt tepki verir ve hidrazon adı verilen güvenli bir katı oluşturur. Depoyu ılık su ile yıkayarak, sıvı hidrazin hidrat salınır. Hidrazin, 1.56 V’luk bir elektromotor kuvvetine ve hidrojen için 1.23 V’ye sahiptir. Hidrazin, oksijen ile bağlanan azot ve hidrojen oluşturmak için hücrede parçalanır ve su bırakır. Hydrazine 1960’lı yıllarda Allis-Chalmers Corp tarafından üretilen yakıt hücrelerinde, uzay uydularında elektrik enerjisi sağlamak için kullanılmıştır.
5 -) Reaktivite
5.1 İnorganik Kimya
5.2 Asit-baz davranışı
Hidrazin, susuz materyalden daha yoğun (1.032 g / cm3) bir monohidrat oluşturur. Hidrazinin, amonyak ile karşılaştırılabilecek bazik (alkali) kimyasal özellikleri vardır. Diprotonlamak zordur:
[N2H5]+ + H2O → [N2H6]2+ + OH− Kb = 8.4 x 10−16
Kb = 1.3 x 10−6
pKa = 8.1
(amonyak için Kb = 1.78 x 10−5)
5.3 Redoks reaksiyonları
Hidrodin’in oksijen (hava) içindeki yanma ısısı 1.941 x 107 J / kg (9345 BTU / lb) ‘dir.Yan ürünlerin tipik olarak azot gazı ve su olması nedeniyle, hidrazin uygun bir indirgeyicidir.
Bu nedenle, su kazanları ve ısıtma sistemlerinde bir antioksidan, oksijen süpürücü ve korozyon önleyici olarak kullanılır. Ayrıca metalik tuzları ve oksitleri, nikel reaktör atıklarından elektroliz nikel kaplama ve plütonyum ekstraksiyonunda saf metallere indirmek için kullanılır. Bazı renkli fotografik işlemler, boya bağlayıcı ve reaksiyona girmemiş gümüş halojenürleri temizlediğinden stabilize edici bir yıkama olarak zayıf bir hidrazin çözeltisi kullanmaktadır. Hidrazin, hidrotermal muamele yoluyla grafen oksidi (GO) indirgenmiş grafen oksite (rGO) dönüştürmek için kullanılan en yaygın ve etkili indirgeyici maddedir.
5.4 Hidrazinyum tuzları
Hidrazin, mineral asitlerle işlemden geçirilerek hidrazinyum katyonunun (N2H5 +) çeşitli katı tuzlarını oluşturmak üzere monoprotonlandırabilir. Ortak bir tuz hidrazinyum sülfattır [N2H5] HSO4, ayrıca hidrazin sülfat olarak da bilinir. Hidrazin sülfat, kanser kaynaklı beden zayıflığına bir tedavi olarak araştırılılmış ancak etkisiz olduğu kanıtlanmıştır.
5.5 Organik Kimya
Hidrazinler birçok organik sentezin bir parçasıdır, çoğunlukla farmasötiklerde pratik önemi bir önem taşır bunun yanı sıra tekstil boyaları ve fotoğrafçılık gibi alanlarda kullanılır.