Karbon 6 Bağ Yapabilir mi?
Bilim insanlarının kırk yıldan daha uzun bir süredir araştırmış olduğu karbonun alt bağ yapabileceği iddiası doğrulandı. Ancak, karbonun altı bağ yapabilmesi istisnai bir durum ve bu X ışınları kullanılarak ilk defa haritalanarak 2 Ocak’ta Angewandte Chemie dergisinde yayınlandı.
Kaliforniya Üniversitesi’nde kimyager olan Dean Tantillo, bu yapı yeni olmamasına rağmen “Biri bu molekülün fotoğrafını gördüğünde inanılmaz bir etki oluşturacağını düşünüyorum. Her ne kadar bize karbonun sadece dört arkadaşı olabileceği öğretilmiş olsa da, karbonun dörtten fazla atomla ilişkilendirilebileceğini insanların fark etmesi çok önemli.” diyor.
Atomlar elektronları paylaşarak bağlanır. Tipik bir bağda, ilgili atomların her birinden birer tane olmak üzere iki elektron paylaşılır. Karbonun kendine ait bu tür dört paylaşılabilir elektronu vardır, bu nedenle diğer atomlarla dört bağ oluşturma eğilimindedir.
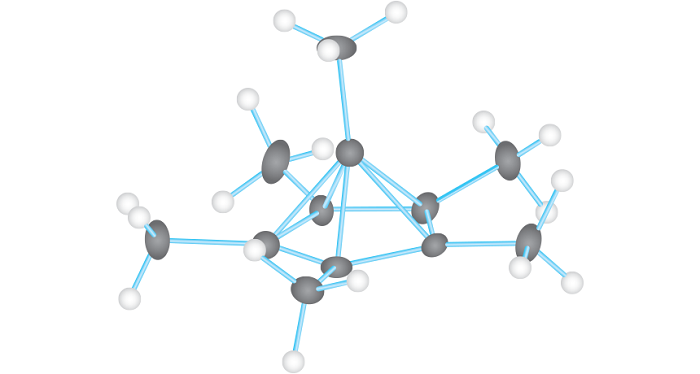
Ancak bu kural her zaman geçerli değildir. 1970’lerde bilim insanları, hekzametilbenzen adı verilen bir molekül hakkında ilginç bir keşif yaptı. Bu molekül, altı karbon atomundan oluşan düz bir altıgen halkaya sahipti. Halkanın her bir köşesinde küçük birer kol gibi altı karbon atomu bağlıydı. Hidrojen atomları ise bu halkanın kollarına bağlıydı. Kalan elektronlar halkanın ortasında hızla dönerek bağları güçlendiriyor ve molekülü daha kararlı hale getiriyordu.
Bilim insanları, molekülden iki elektron ayrılınca geriye kalan pozitif yüklerden dolayı şeklinin değişeceğine yönelik bazı kanıtların ortaya çıktığını düşünüyordu. Bir karbon atomunun diğer altı karbona bağlanması için yeniden düzenleniyor gibiydi. Ancak araştırmacılar, bu yapıyı deneysel olarak doğrulayamadılar.
Farklı bir laboratuvarda bu sorun tekrar ele alınarak incelendi. Free University of Berlin’den bir kimyager olan çalışmanın ortak yazarı Moritz Malischewski, yüklü bir heksametilbenzeni oluşturmanın çok zor olduğunu ancak, çok güçlü bir asit içinde karalı hale gelebileceğini düşünüyor. Eski çalışmadaki deneysel ayrıntılar biraz belirsiz olsa da, biraz uğraştıktan sonra yüklü molekülü elde etmeyi başardı. Moritz ve Konrad Seppelt molekülü diğer moleküllerle kristalleştirdi ve kristal yapının üç boyutlu bir haritasını elde etmek için X ışınlarını kullandı.
Bilim insanları, heksametilbenzenin iki elektron kaybettiğinde kendini yeniden düzenlediğini X ışını kullanarak doğruladı. Bir karbon halkadan ayrılarak yeni bir pozisyon alıyor ve beş yüzlü karbon piramitine dönüşüyor. Piramidin tepesindeki karbonlardan beşi alttaki karbona ve biri ise yukardaki karbona bağlanıyor.
Malischewski molekülün kimyasal bağlarının uzunluğunu ölçtüğünde, standart karbon-karbon bağından daha uzun olduğunu fark etti. Genellikle bağ uzunluğu arttıkça gücü azalır. Karbon ne kadar fazla bağ yaparsa o kadar zayıf bağlara sahip olur.
Sonuç olarak, karbon altı bağ yapmaz çünkü karbon-karbon bağı iki elektronluk bir bağ olduğu için paylaşacak dört elektrona sahiptir. Yani, karbon altı bağ arasında elektronlarını zayıf olarak paylaşır.
Kaynak: sciencenews.org