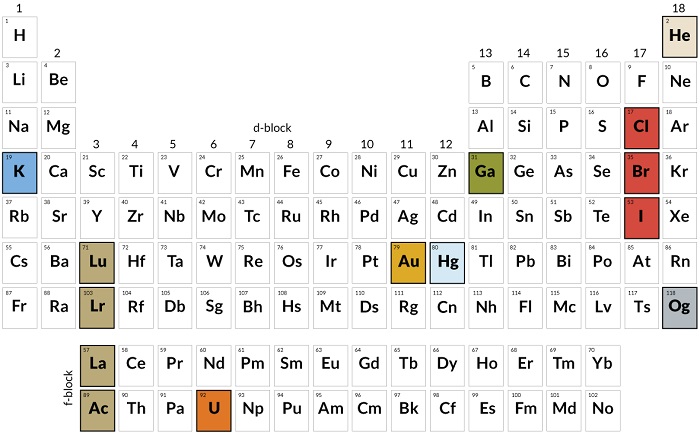
150 Yılını Dolduran Periyodik Tablo Elementlerinden Daha Çok Hikaye İçeriyor
Fotoğraf : Tabloda yer alan her element kendi hikayesine sahip. Hep birlikte bilinen kimyanın repertuarını oluşturuyorlar.
Organize diliş biçimi buluşlara ve garip reaksiyonlara dair pek çok hikaye barındırıyor.
Bu grup ve periyodları tanıyor musunuz? Belki üzün süre önce aldığınız bir kimya dersinden tablonun organizasyonuna dair birkaç tozlu detay anımsıyor olabilirsiniz. Elementler proton sayılarına veya atom numaralarına göre sıralanıyorlar. Metaller genellik solda, ametaller ise sağa doğru. En sağdaki grupta, diğer elementlerde etkileşim kurma isteği olmayan soy gazlar yer alıyor.
Dmitrii Mendeleev 150 yıl önce kendi periyodik tablosunu önerdiğinde, hiç kimse bir atomun içeriside ne olduğunu bilmiyordu. Bugün biliyoruz ki bir elementin tablodaki yeri, o elementin kimyasal özelliklerinin yanı sıra elementin proton sayısı ve elektron dizilimi ile ilgili de bilgi veriyor.
Bir bakışta elementlerin birbirleri ile olan ilişkilerini ortaya koyarak, doğanın repertuarını bize açıyor. Ancak elementler aynı zamanda kendi başlarına da apayrı buluş hikayelerine sahipler. Bu yazıda birkaç favori hikayeyi bulabilirsiniz.
Periyodik tablo hali hazırda yaşan bir süreç. Dört yeni element henüz 2016’da isimlendirildi. Sınırları yeniden çizen araştırma eforlarına rağmen hala pek çok gizem mevcut.
Bonanza Muzu
Potasyum
Muz meyvesi yüksek miktarda, potasyumun radyoaktif iztotopu olan potasyum-40 içerir. Tek bir muzun içinde bulunan potasyum-40 bile elektronun antimadde karşılığı olan pozitronu üretebilir.
Nereye ait?
Lutesyum, Lavrensyum, Lantanyum, Aktinyum
Lutesyum ve lavrensyumun şekilde gösterilen üst pozisyondaki konumu hakkında herkes ikna olmuş değil. Royal Society of Chemistry, dış elektron dizilimlerini öncelikli kabul ederek, lantanyum ve aktinyum gruplarını o bölüme yerleştirerek, lütesyum ve lavrensyumu f bloğunun sonuna itiyor. Kimyasal isimlendirmelerden sorumlu olan International Union of Pure and Applied Chemistry, 2015’ten beri bu yerleştirme sorununu araştırıyor.
Laboratuvar dışında
Uranyum
Fransız fizikçi Henri Becquerel 1896 yılında uranyum tozlarını fotoğraf plakalarının üzerine koyarak yanlışlıkla radyoaktiviteyi keşfettiği için 19,3 yılında Nobel Fizik Ödülü’nü kazandı. Uranyum aynı zamanda periyodik tabloda yer alan ve doğada bulunabilen son element. Geri kalanların laboratuvarda yaratılması gerekiyor.
Özel Parıltı
Altın
Albert Einstein’ın izafiyet teoremi altının rengini açıklayabiliyor. Bu teoreme göre izafiyet nedeniyle elektronların enerjisi kaydığı için, metal mavi ışığı soğuruyor ve sarı olarak görülüyor.
Kamp Yeri İpuçları
Cıva
Meriwether Lewis ve William Clark Pasifik Okyanusu’na vardıklarında Rush’s Thunderbolts adıyla bilinen cıva içerikli yumuşatıcıdan 1300 galon taşıyorlardı. Cıva, bu olaydan yaklaşık 200 yıl kadar sonra Lewis ve Clark’ın kamp yaptığı Lolo bölgesinde keşfedildi.
Kestirimci Güç
Galyum
Mendeleev ilk periyodik tablosunda bilinen tüm elementleri doğru şekilde yerleştirmek için boşluklar bıraktı. 31. Element Galyum sonradan eklenen ilk element olma özelliğini taşıyor ve 1875 yılında periyodik tablodaki yerini aldı. Popüler kimya gösterilerinde kullanılan Glayum oda sıcaklığında katı haldeyken, 29,7°C üzerine çıkınca eriyor. Böylece sıcak çaya batırılınca eriyen çay kaşıkları yapmak mümkün hale geliyor.
Dışarıda
Helyum
Helyum elementi fiziksel olarak bulunmadan neredeyse 30 yıl kadar önce 1868 yılında güneş ışığı spektrumunda ince sarı bir çizgi olarak keşfedildi. Geçen yıl, bilim insanları ilk gözlemlenen helyumun dış gezegenlerden birisinin atmosfere olan etkisi olduğunu raporladı.
Türünün Üç Örneği
Klor, Brom, İyot
Alman kimyager Johann Wolfgang Döbereiner; klor, brom ve iyota “triad-üçlü” adını veriyor. Atomik ağırlığı 79,90 olan brom, klor (35,45) ve iyodun (126,90) tam orta noktasında kalıyor ve diğer metallerle hızlıca tepkimeye girip tuzları oluşturabiliyor. Döbereiner bu tepkimeleri 1817 yılında, Mendeleev kendi periyodik tablosunu önermeden neredeyse yarım yüzyıl daha önce ortaya koyuyor.
Son?
Oganeson
Oganeson, soy gaz grubunun en altında yer alarak bugün kullandığımız periyodik tablonun sonunu temsil ediyor. Ancak grubunun diğer üyeleri kadar içine kapanık değil. Bu element hızlıca elektron alıp verebiliyor ve teoride atomlar halinde kümelenebiliyor. Kimyagerler tarafından ortaya çıkarılan birkaç oganeson bir milisaniyeden daha kısa bir süre hayatta kalmayı başardı. Bilim insanları 118’den sonraki elementleri ortaya çıkartabilmek için atomları ezmeye devam ediyorlar.
Kaynak : sciencenews.org