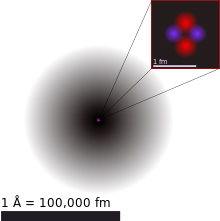
Helyum
| Adı | Helyum |
| Sembolü | He |
| Atom Numarası | 2 |
| Atomik yığın | 4,002602 |
| Erime Nok. | -272,0 oC |
| Kaynama Nok. | -268,6 oC |
| Elektron/proton | 1 |
| Nötron sayısı | 2 |
| Sınıfı | Noble(Soygaz) |
| Kristal yapı | Hekzagonal |
| Yoğunluk | 0,1785 g/cm3 |
Evrende en çok bulunan ikinci element helyum; ismi Yunan Tanrıçası Helios’ dan gelir. İlk kez güneş yüzeyinde keşfedilmiştir. 1868 yılında Fransız astrolog Jules Janssen, güneş tutulması sırasında sarı bir çizgi fark etmesiyle aynı sene içinde Norman Lockyer güneş spektrumlarında yeni bir elementin varlığını tespit etmiştir. 1895 yılında Ramsay, uranyum madeni Kleyevitinde aynı zamanlarda İsveçli kimyagerler Nils Langlet ve Theodor Cleve Kleyevitte helyuma rastlamışlardır.
Hidrojenden sonra en hafif gazdır. Renksiz ve kokusuzdur, soygaz (inert) olması sebebiyle tepkimeye girmez ve bu yüzden eylemsizdir. Hidrojenden ağırdır ama hidrojen yanıcı olduğundan helyum, sıcak hava balonları ve zeplinlerde hidrojenin yerini almıştır.
Helyum doğal gaz kaynaklarından elde edilebilir. Yeryüzünde Helyum bakımından zengin doğal gaz kaynakları sınırlı sayıda ülkede mevcuttur, bunlar ABD, Polonya, Cezayir ve Rusya’dır. Çok değerli bir gaz olan Helyum, bu değeri nedeni ile uluslararası işletme ve ticareti yapılan tek endüstriyel gazdır.
Tamamen asal, havadan hafif, küçük molekül yapısı olan ancak yüksek moleküler enerjiye sahip, sıvılarda çözünmeyen ve sıvı hali bilinen en soğuk gazdır.
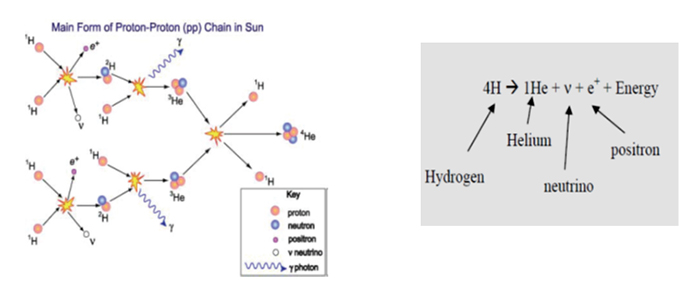
Şekil 1 : Güneşte meydana gelen reaksiyonlar
Üstteki şekilde de hidrojenden laboratuvar ortamında üretilmiş He görülmektedir. Big bang teorisine göre helyum hidrojenden türemiş olduğu görülmektedir.
Kullanım Alanları
- Kaynak alanında koruyucu gaz olarak
- Balon ve zeplinlerde
- Kaçak kontrol gazı
- Dalış gazları
- Astım vb. hastalığı olanlarda solunum gazı karışımlarında
- Manyetik Rezonans (MR) cihazlarında
- Lazer gazlarında ve analitik cihazlarda
- Roket itici gazlarında
- Süper iletkenlerde
Güneş ve Helyum
Güneş katı bir cisim değil, büyük bir gaz topudur. Çok büyük oranda (% 92,1) hidrojen, daha az oranda (% 7,8) helyum ve çok az oranda diğer gazlardan oluşmuştur.
Güneş’in çekirdeğindeki basınç ve sıcaklıktan dolayı hidrojenin çarpması ve birleşmesi yeterlidir. Hidrojenin helyuma dönüşmesi için gerekli ısıya termonükleer enerji denir. Bundan dolayı Güneş, büyük bir nükleer reaktöre benzetilebilir.
İzotopları
En hafif nadir gaz olan helyumun doğada iki izotop olarak bulunur. Alışılmış formu 4He dür. 4 nükleon sayısı 2 proton ve 2 nötrondur. Diğer helyum alışılmamış formu 3He olup 1 nötron eksiktir. Bu nedenle diğerine göre daha hafiftir. Ağır helyum, diğer helyuma göre doğada 10 milyon kat daha sık rastlanır. Ancak son 50 yılda nükleer santrallerde büyük miktarlarda 3He üretilmesi olanaklı hale gelmiştir.
Süper iletkenlik
Helyum gazı mutlak sıfırın (-273,15 oC) 4 derece üzerine kadar soğutulursa yoğunlaşarak sıvı hale geçer. Her iki helyum atomu da sıvı halleri benzer özellikler gösterirler. Sıvı helyum süper iletken mıknatıslarda olduğu gibi yaygın bir şekilde soğutucu olarak kullanılırlar. Sıcaklık düştükçe sıvı helyum izotopları arasında büyük farklar ortaya çıkmaya başlar. İçsel hareketlere karşı bütün dirençlerini kaybederler ve süper akışkan olurlar.
Hollandalı fizikçi Heiki K. Onnes’ in ekibi helyumu -268 oC’ de sıvılaştırmayı başardı ve metallerin sıvı helyuma batırılarak nasıl davrandığı incelendi. Onnes’ in ekibi yıllardır civalı termometrelerde kullanılmak üzere civa dirençler ihmal ediliyordu. 1911 yılının Nisan ayında elektrik akımının sıvı helyum kullanılarak soğuttukları civa telden hiç engelle karşılaşmadan ilerlediği gözlenmiş. Civanın iletkenliği sonsuz olmuş, elektrik direnci sıfıra inmişti. Sıvı helyum eldesi ve Onnes’ in süper iletken olarak adlandırdığı bu gözlem ona 1913 Nobel fizik ödülünü getirecekti.
Kaynaklar
- Bilim ve Teknik, 2011 Temmuz
- Messer/Heluim
- The Origin of Elements/Helium
- Wikipedia/Helium Application
Yazar : İsmail BAYRAKTAR
Üniversite : Adnan Menderes Üniversitesi
Bölüm : Yüksek Kimyager
Dergi : Sayı 18– Sayfa 16