Olağandışı hidrojen bağları proteinlerde kimyacıların düşündüğünden daha büyük bir rol oynuyor
Yapılan çalışmalara göre bu etkileşim bütün proteinlerin % 94’ünü etkiliyor.
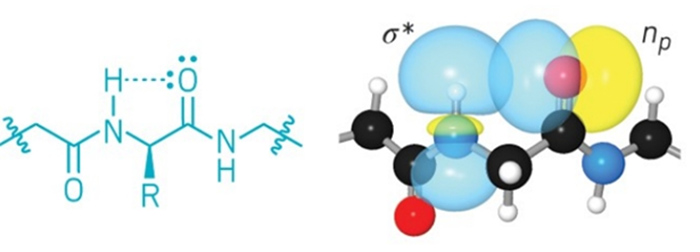
1960’lardan beri, kimyacılar aynı aminoasit içinde amit hidrojeni ile karbonil oksijeni arasında yer alan olağandışı bir hidrojen bağı olduğunu biliyorlardı. Fakat C5 hidrojen bağı olarak adlandırılan bu etkileşimin, proteinlerdeki aminoasitlerden daha büyük bir mesele olduğunu göstermek çok zordu.
*C5 hidrojen bağları, aynı aminoasit içinde amit hidrojeni ile karbonil oksijeni arasında yer alır. (Nat. Chem. Biol.)
Wisconsin Üniversitesinden (Madison) biyokimya profesörü Ronald T. Raines ve master öğrencisi Robert W. Newberry bu hidrojen bağının proteinleri stabilize etmeye yardımcı olduğuna dair önemli deneysel ve hesaplamalı kanıtlar rapor etmişlerdir. (Nat. Chem. Biol. 2016, DOI:10.1038/nchembio.2206).
Utah State Üniversitesinde hidrojen bağları üzerine çalışan kimya profesörü Steve Scheiner, özellikle çok sayıda başka faktörlerin devreye girdiği bir dipeptitten çok daha büyük olan sistemlerde, bu hidrojen bağının enerjisini ölçmenin sorun olduğunu ve bu yeni çalışma sayesinde, hidrojen bağının varlığının doğrulanmasının yanı sıra, bu bağın etkisinin bazı kantitatif ölçümleri için önemli adımlar atıldığını ifade etmektedir.
Raines ve Newberry bir hidrojen bağı gibi davranan C5 etkileşimini göstermek için, triptofan fermuarlar denilen, 12 aminoasit uzunluğunda olan β-saç tokalarına benzer bir modelde bulunan peptidlerin spektroskopik ölçümlerini ve kuantum mekaniksel hesaplamalarını kullanmışlardır. Daha sonra protein yapılarının bir veri tabanı analizini yapmak için aminoasitlerin yaklaşık %5’ini ve bütün proteinlerin %94’ünü etkileyen bu etkileşimin yaygınlığını gösteren biyoinformatik medodunu kullanmışlardır.
C5 hidrojen bağı bazı sınırlamaların olduğu düz yapılarda çok güçlüdür. Raines’e göre bu bağ β-levhalarında bulunmak zorundadır. Aksi takdirde, oksijen ve hidrojen atomları birbirinden çok uzakta bulunacaklardır. Raines, bu etkileşimin Alzheimer hastalığı gibi etkisi bulunan, amiloid oluşturan proteinler açısından zengin olan β-levhalarını stabilize etmek için önemli bir adım olacağını ileri sürmektedir.
Raines, ‘Biz, veri tabanındaki benzer yapıların tahmin edilmesinde çok iyiyiz. Sıfırdan yapıları tahmin etmek çok daha zordur. Gerçekte, protein katlanması sorununu çözmek için, bizim matematikte çok daha iyi olmamız gerekiyor. Kararlı bir yapıya yol açan temel güçleri anlamaya ihtiyacımız var.’ diyerek kararlılık enerjisini ve protein katlanması modelini birleştiren bu yöntemin protein yapılarının açıklanması hakkında yardımcı olabileceğini ifade etmektedir.
Kaynak : acs.org
Haberi Çeviren : Canan Kula
Üniversite : Hacetttepe Üniversitesi (Cranfield University Forensic Investigation Yüksek Lisans Öğrencisi)
Bölüm : Kimya Bölümü
Mail : canankula@gmail.com
Not : Haberlerin dergi yönetimi ile çevirene haber verilmeksizin yayınlanması, kopyalanması, kendi web sitenize eklenmesi kesinlikle yasaktır. Bir yerde yayınlamayı düşünenler iletisim@inovatifkimyadergisi.com adresine ve de haberi çeviren arkadaşımıza mail atarak durumu belirtmeleri gerekmektedir.